
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон (начало) термодинамики
|
|
|
|
Первый закон термодинамики является законом сохранения энергии в тепловых процессах.
 ,
,  . (2.41) Согласно первому закону термодинамики количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на работу, совершаемую системой над внешними телами. Формула (2.41) записана как для элементарных процессов, так и для процесса, при котором происходит конечное изменение параметров системы.
. (2.41) Согласно первому закону термодинамики количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на работу, совершаемую системой над внешними телами. Формула (2.41) записана как для элементарных процессов, так и для процесса, при котором происходит конечное изменение параметров системы.
Отметим различие между внутренней энергией системы, с одной стороны, и работой и количеством теплоты, с другой стороны. При переходе системы из одного состояния в другое она обменивается с внешними телами энергией, при этом совершается работа и передается количество теплоты. Это приводит к изменению внутренней энергии системы. В конечном состоянии внутренняя энергия принимает вполне определенное значение, а работа и теплообмен прекращаются.
Следовательно, состояние системы нельзя охарактеризовать определенными значениями работы и количеством теплоты – эти величины зависят от процесса перехода и характеризуют только сам этот процесс перехода. Так, например, нельзя сказать, что в данном состоянии количество теплоты равно 10 Дж, а работа составляет 5 Дж.
Чтобы наглядно показать различие между внутренней энергией и количеством теплоты и работой, их малые изменения для элементарных процессов записывают, как  и
и 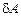 , а для внутренней энергии как
, а для внутренней энергии как  .
.
Различие между этими величинами наглядно проявляется в зависимости значений работы и количества теплоты от способа перехода из одного состояния в другое (рис. 2.8)
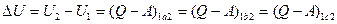 . (2.42)
. (2.42)
Из формулы (2.42) следует, что переход различными путями из состояния 1 в состояние 2 приводит к изменению работы системы и количества теплоты, получаемой или отдаваемой системой при таком переходе, а изменение внутренней энергии при этом остается неизменным.
|
|
|
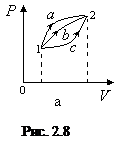 Зависимость количества теплоты от вида происходящего процесса приводит к аналогичной зависимости и теплоемкости системы. Поэтому вводят различные теплоемкости, описывающие протекание процессов при постоянном объеме (
Зависимость количества теплоты от вида происходящего процесса приводит к аналогичной зависимости и теплоемкости системы. Поэтому вводят различные теплоемкости, описывающие протекание процессов при постоянном объеме ( ), давлении (
), давлении ( ), температуре (
), температуре ( ) и т.д.
) и т.д.
Для кругового процесса первый закон термодинамики запишется таким образом:
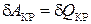 . (2.43)
. (2.43)
Формула (2.43) позволяет сформулировать первый закон термодинамики в следующем виде: невозможен вечный двигатель первого рода, т.е. такое периодически действующее устройство, которое совершало бы работу большую, чем подводимая извне энергия.
Формула (2.43) устанавливает эквивалентность двух форм передачи энергии - работы и теплоты. Они эквивалентны, т.к. представляют собой две формы передачи одной и той же физической величины - энергии, а также при совершении кругового и изотермического процессов работа и количество теплоты совпадают, приводят к одинаковым результатам.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 254; Нарушение авторских прав?; Мы поможем в написании вашей работы!