
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ №2. Молекулярно-кинетической теорией называется учение, которое объясняет строение и свойства тел движением и взаимодействием атомов и молекул
|
|
|
|
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
МОЛЕКУЛЯРНАЯ ФИЗИКА.
Молекулярно-кинетической теорией называется учение, которое объясняет строение и свойства тел движением и взаимодействием атомов и молекул, из которых состоят тела.
Основные положения МКТ:
1. Все тела состоят из частиц: молекул и атомов, в состав которых входят более мелкие элементарные частицы.
2. Частицы, из которых состоят тела, находятся в непрерывном хаотическом движении.
3. Между частицами любого тела существуют силы взаимодействия: притяжения и отталкивания.
Молекула – наименьшая устойчивая частица какого-либо вещества, обладающая его химическими свойствами.
Молекула состоит из одного или нескольких атомов одинаковых или различных химических элементов.
Атом состоит из положительно заряженного ядра (соединенные протоны и нейтроны), вокруг которого на расстояниях, превышающих размер ядра более чем в 1000 раз, вращаются электроны.
Атомы и молекулы электрически нейтральны.
Броуновское движение – непрерывное хаотическое движение частиц, помещенных в жидкость или газ в такие условия, при которых сила тяжести не влияет на их движение (взвешенные частицы). Причиной броуновского движения частиц являются непрерывные беспорядочные соударения этих частиц с молекулами жидкости (газа).
Количество вещества ν – физическая величина, характеризующая число структурных единиц в теле. Единицей измерения количества вещества является моль (моль). В одной структурной единице (в одном моле) содержится 6,02∙1023 атомов (молекул). Такое число атомов называется числом Авогадро NA:
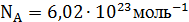 .
.
Количество вещества равно отношению числа N атомов (молекул) в теле к числу Авогадро NA:
|
|
|
 (2.1)
(2.1)
Или
 (2.2)
(2.2)
где m – масса тела, μ – молярная масса тела.
Молярная масса – масса вещества, взятого в количестве одного моля. Единица молярной массы – килограмм на моль (кг/моль). Молярные массы веществ, молекулы которых состоят из одного атома, приведены в Периодической системе Менделеева в г/моль, что следует учитывать при решении задач.
На основе молярной массы и числа Авогадро можно рассчитать массу молекулы по формуле:
 (2.3)
(2.3)
 |
Размер молекулы может быть оценен как размер a кубика, в котором содержится одна молекула (Рис. 2.1):
 (2.4)
(2.4)
А объем кубика V, в свою очередь, равен отношению массы молекулы m к плотности вещества ρ:
 (2.5)
(2.5)
Тогда, с учетом (3), размер молекулы a равен:
 (2.6)
(2.6)
Молекулярно – кинетическая теория идеальных газов.
Идеальный газ – идеализированная модель реальных газов. Идеальным газом называется газ, который удовлетворяет следующим условиям:
1. Молекулы газа не взаимодействуют друг с другом.
2. Соударения молекул друг с другом и со стенками сосуда абсолютно упругие.
3. Собственный объем молекул пренебрежимо мал по отношению к размерам сосуда, в котором находится газ.
Система, состоящая из большого числа молекул, называется макросистемой. Равновесное состояние макросистемы описывается так называемыми параметрами состояния. Различают микропараметры и макропараметры состояния. К микропараметрам относят массу молекул, их скорость, среднюю квадратичную скорость молекул, среднюю кинетическую энергию молекул и др. Это такие параметры, которые можно отнести к одной молекуле макросистемы.
Макропараметры состояния характеризуют равновесную систему в целом. К ним относятся объем V, давление P, температура T, плотность ρ, концентрация n и пр. Молекулярно-кинетическая теория идеального газа устанавливает связь между микро и макропараметрами газа.
|
|
|
Основное уравнение молекулярно кинетической теории:
 (2.7)
(2.7)
где 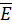 средняя кинетическая энергия молекул:
средняя кинетическая энергия молекул:
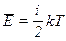 , (2.8)
, (2.8)
где k – постоянная Больцмана, i – число степеней свободы, Т – температура.
Связь между макропараметрами состояния дает уравнение Менделеева-Клапейрона:
 (2.9)
(2.9)
где P – давление, V – объем газа, μ – молярная масса газа, R – универсальная газовая постоянная, Т – температура газа.
Распределение Максвелла.
Молекулы газа совершают неупорядоченное, хаотичное движение. Это означает, что ни одно из направлений движения не является преимущественным – все направления движения встречаются одинаково часто. Соударения между молекулами приводят к тому, что их скорости непрерывно изменяются по направлению и величине, поэтому среднее значение проекции скорости одной молекулы на ось x (y или z) и среднее значение вектора ее скорости равно нулю. В связи с этим для исследования применяется статистический метод: вычисляются средние значения физических величин, характеризующих движение всех молекул. Для совокупности всех молекул вводятся следующие величины:
А) Средняя арифметическая скорость движения N молекул:
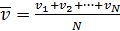 (2.10)
(2.10)
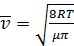 (2.11)
(2.11)
В) Средняя квадратичная скорость движения N молекул:
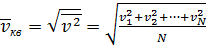 (2.12)
(2.12)
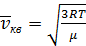 (2.13)
(2.13)
По молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул в газе, находящемся в состоянии равновесия при T=const, остаются постоянной. Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся во времени распределение молекул по скоростям, которое подчиняется статистическому закону, который был выведен Дж. Максвеллом. Закон Максвелла описывается некоторой функцией f(υ), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dυ, то на каждый интервал скорости будет приходиться некоторое число молекул dN(υ), имеющих скорость, заключенную в этом интервале. Функция f(υ) определяет относительное число молекул  , скорости которых лежат в интервале от υ до υ+dυ:
, скорости которых лежат в интервале от υ до υ+dυ:
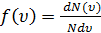 (2.14)
(2.14)
Применение теории вероятностей позволяет получить закон распределения молекул идеального газа по скоростям:
|
|
|
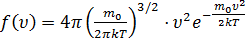 (2.15)
(2.15)
Видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметров состояния (от температуры).
С) Средняя кинетическая энергия молекул газа:
 (2.16)
(2.16)
Здесь m=Nm0 – масса газа.
Исходя из распределения молекул по скоростям, можно найти распределение молекул газа по значениям кинетической энергии E. Для этого нужно перейти от переменной υ к переменой  :
:
 (2.17)
(2.17)
Распределение Больцмана.
Распределением Больцмана называется выражение:
 (2.18)
(2.18)
Здесь n и n0 – концентрация молекул на высоте h и на высоте h=0, соответственно, m0gh – потенциальная энергия молекулы в поле тяготения. Из распределения Больцмана следует, что при постоянной температуре концентрация, а значит и плотность ( газа больше там, где меньше потенциальная энергия его молекул.
газа больше там, где меньше потенциальная энергия его молекул.
ОСНОВЫ ТЕРМОДИНАМИКИ
Полная и внутренняя энергия тела (системы тел)
Полная энергия Е системы состоит из
а) кинетической энергии ее макроскопического движения как целого
б) потенциальной энергии, обусловленной наличием внешних силовых полей, например электрического или гравитационного поля;
в) внутренней энергии U
Внутренней энергией тела (системы тел) U называется энергия, зависящая только от термодинамического состояния тела или системы тел.
Внутренняя энергия системы зависит от характера движения и взаимодействия частиц в системе. Она состоит из следующих частей:
а) кинетической энергии теплового хаотического движения частиц, образующих систему (молекул, атомов, ионов и Др.);
б) потенциальной энергии частиц, обусловленной силами их межмолекулярного взаимодействия;
в) энергии электронов в электронных слоях, атомов и ионов;
г) внутриядерной энергии.
Внутренняя энергия определяется термодинамическим состоянием системы и не зависит от того, каким образом система оказалась в данном состоянии. Началом отсчета внутренней энергии считается такое состояние системы, в котором U равна нулю. Обычно полагают, что внутренняя энергия системы равна нулю при абсолютном нуле температуры (Т=0). Однако практический интерес представляет не сама внутренняя энергия, а ее изменение ΔU при переходе системы из одного состояния в другое:
|
|
|
 (2.19)
(2.19)
где i – число степеней свободы.
Работа
Различаются работа А, которая совершается системой над внешними телами, и работа А', которая совершается внешними телами над системой. Эти работы численно равны и противоположны по знаку: А=-А'. Работа, совершаемая при изменении объема газа от V1 до V2:
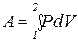 (2.20)
(2.20)
Выражения, позволяющие найти работу в различных изопроцессах имеют вид:
Изотермический (T=const):
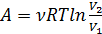 (2.21)
(2.21)
Изохорный (V=const):
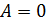 (2.22)
(2.22)
Изобарный (P=const):
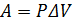 (2.23)
(2.23)
Теплота
Теплотой называется такая форма передачи энергии, при которой осуществляется непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел. Процесс передачи внутренней энергии без совершения работы называется теплообменом. Мерой энергии, переданной в форме теплоты в процессе теплообмена, служит величина, называемая количеством теплоты, или просто теплотой.
Теплота, как и работа, является не видом энергии, а формой ее передачи. Теплота и работа обладают тем общим свойством, что они существуют лишь в процессе передачи энергии, а их численные значения зависят от вида этого процесса.
Если телу передается энергия в форме теплоты, то это увеличивает энергию хаотического теплового движения его частиц и непосредственно приводит только к увеличению внутренней энергии тела.
Первый закон (начало) термодинамики
Количество теплоты Q, которое получено телом (системой), расходуется на изменение внутренней энергии ΔU и на работу А системы (тела) против внешних сил:
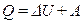 (2.24)
(2.24)
Применительно к изопроцессам первое начало термодинамики для идеального газа имеет вид:
Изотермический:
 (2.25)
(2.25)
Все подведенное количество теплоты расходуется на работу против внешних сил.
Изохорный:
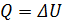 (2.26)
(2.26)
Количество теплоты расходуется на увеличение внутренней энергии газа. Работу газ не совершает.
Изобарный:
 (2.27)
(2.27)
Количество теплоты Q расходуется и на изменение внутренней энергии ΔU и на работу и на работу расширения А.
Адиабатический (Q=const):
 (2.28)
(2.28)
В условиях отсутствия теплообмена с внешней средой, работа совершается за счет убыли внутренней энергии системы.
Обратимые и необратимые процессы
Термодинамический процесс называется обратимым (обратимый процесс), если он допускает возвращение тела (системы) в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Процесс является обратимым, если при совершении его сначала в прямом, а затем в обратном направлении в исходные состояния возвращаются как само тело (или система), так и все внешние тела, с которыми тело (или система) взаимодействовало. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
Термодинамический процесс, не удовлетворяющий условиям обратимости, называется необратимым термодинамическим процессом. Все реальные процессы протекают не бесконечно медленно, а с конечной скоростью. Все они сопровождаются трением, диффузией и теплообменом при конечной разности температур тела (системы) и внешней среды. Поэтому все реальные процессы являются неравновесными. Следовательно, все реальные процессы являются необратимыми.
Круговым процессом или циклом называется термодинамический процесс, в результате совершения которого рабочее тело возвращается в исходное состояние. Круговые процессы являются основой тепловых двигателей. Прямым циклом называется круговой процесс, в котором рабочее тело совершает положительную работу за счет сообщенной ему теплоты.
Обратным циклом называется круговой процесс, в котором рабочее тело совершает отрицательную работу. Это означает, что над рабочим телом совершается работа и от него отводится эквивалентное ей количество теплоты.
В тепловом двигателе рабочее тело совершает прямой цикл, а в холодильной установке — обратный цикл.
Циклом Карно называется прямой обратимый круговой процесс (рис.2.2), состоящий из двух изотерм 1—1' и 2 — 2' и двух адиабат 1 — 2 и 1' — 2'. При изотермическом расширении 1-1' рабочее тело получает от нагревателя — источника энергии с постоянной температурой Т1 — количество теплоты Q1. При изотермическом сжатии 2 — 2' рабочее тело отдает холодильнику, имеющему постоянную температуру Т2 (Т2<.Т1), количество теплоты Q2. При адиабатном расширении сжатии энергия извне к рабочему телу не поступает и эти процессы происходят за счет изменения его внутренней энергии.
Термодинамическим коэффициентом полезного действия (к. п. д.) произвольного цикла называется отношение работы А, совершенной рабочим телом в прямом цикле, к количеству теплоты Q1 сообщенному рабочему телу нагревателем:
 (2.29)
(2.29)
Термодинамический к. п. д. обратимого цикла Карно не зависит от природы рабочего тела и определяется только температурами нагревателя Т1 и холодильника Т2:
 (2.30)
(2.30)
η<1, ибо практически невозможно осуществить условие Т1→∞ и теоретически невозможно осуществить холодильник, у которого Т2=0.
В обратимом цикле Карно отношение температур нагревателя и холодильника равно отношению количеств теплоты, соответственно отданной и полученной ими в цикле:
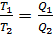 (2.31)
(2.31)
Второй закон (начало) термодинамики
Первый закон термодинамики не позволяет определить, в каком направлении может происходить термодинамический процесс. Например, основываясь на законе сохранения и превращения энергии, нельзя предвидеть, в каком направлении будет происходить теплообмен между двумя телами, нагретыми до различных температур: с точки зрения первого закона термодинамики одинаково возможен как переход энергии в форме теплоты от более нагретого тела к менее нагретому, так и обратный переход. Первый закон термодинамики допускает создание вечного двигателя второго рода. Так называется двигатель, в котором рабочее тело, совершая круговой процесс, получало бы энергию в форме теплоты от одного внешнего тела и целиком передавало бы ее в форме работы другому внешнему телу. Невозможность создания вечного двигателя второго рода является утверждением, вытекающим из обобщения многочисленных опытов. Оно называется вторым законом (началом) термодинамики и имеет несколько эквивалентных друг другу формулировок:
а) невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от менее нагретого тела к более нагретому телу (формулировка Клаузиуса);
б) невозможен периодический процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу (формулировка Кельвина).
Энтропия
Энтропия – функция состояния, дифференциалом которой является приведенное количество теплоты:
 (2.32)
(2.32)
Приведенным количеством теплоты называется отношение теплоты Q, полученной телом в изотермическом процессе, к температуре T теплоотдающего тела. Для обратимых процессов ΔS=0
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!