
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмос. Осмотическое давление
|
|
|
|
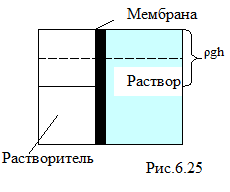 Явление проникновения растворителя в раствор через пористую перегородку (мембрану), непроницаемую для растворённого вещества и отделяющую раствор от чистого растворителя, называется осмосом.
Явление проникновения растворителя в раствор через пористую перегородку (мембрану), непроницаемую для растворённого вещества и отделяющую раствор от чистого растворителя, называется осмосом.
Через мембрану осуществляется обмен молекулами растворителя, находящегося по обе стороны от мембраны. В результате преимущественного движения молекул растворителя в сторону раствора равновесие в системе растворитель - мембрана - раствор поддерживается с помощью осмотического давления (рис.6.25), производимого растворённым веществом в растворе. Осмотическое давление можно измерить с помощью гидростатического давления раствора, поскольку подъём уровня жидкости раствора будет происходить до тех пор, пока гидростатическое давление, равное ρgh, не окажется равным осмотическому.
Это явление было открыто в середине 19 века. Количественное исследование осмоса проводил ботаник Пфеффер в 1877 году. А первый нобелевский лауреат по химии Якоб Хендрик Вант-Гофф (1852-1911; премия 1901 года за вклад в термодинамику и химию) вывел простое уравнение, аналогичное уравнению состояния идеального газа:
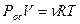 (6.55)
(6.55)
Здесь Рос – осмотическое давление, V – объём раствора, ν- число молей молекул растворённого вещества, R – универсальная газовая постоянная, Т- абсолютная температура. Осмотическое давление не зависит от вида мембраны или от рода растворителя. Закон Вант-Гоффа не справедлив для электролитов.
Осмотическое давление играет большую роль в жизни животных и растений. Различают статический и динамический методыизмерения осмотического давления. Статический метод основан на измерении избыточного гидростатического давления по высоте столба жидкости раствора. Динамический метод заключается в измерении скоростей всасывания и выдавливания растворителя из осмотической ячейки при различных значениях избыточного давления. В качестве мембран обычно применяют плёнку из целлофана, природных и синтетических полимеров, пористые керамические и стеклянные перегородки. Осмотическое давление может достигать значительной величины. Например, по данным [16], 4%-ный раствор сахара при комнатной температуре имеет осмотическое давление около 0,3 МПа, а 10%-ный – около 10 МПа. Осмотическое давление морской воды составляет 0,27 МПа.
|
|
|
Осмотическое давление необходимо учитывать и в медицине, например, при вливании в вены раствора поваренной соли (физиологический раствор), необходимо рассчитывать концентрацию соли в растворе, чтобы воспрепятствовать разбуханию красных кровяных телец и разрыву их оболочек [16]. Известно, что давление внутри красных кровяных шариков равно 0,8 МПа, а также то, что кровь является электролитом, поэтому формула Вант-Гоффа (6.55) даёт большие погрешности при расчётах и завышенное количество требуемой поваренной соли. Потому для расчёта концентрации поваренной соли используется адаптированная для электролитов формула Вант-Гоффа, где учитывается поправка к осмотическому давлению за счёт электрических сил. Осмотическое давление должно быть равно 0,7 МПа, поскольку вместе с внешним давлением оно должно уравновешивать давление внутри красных кровяных телец. В результате рассчитанная концентрация поваренной соли в физиологическом растворе должна быть равна 8,9 г/л.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!