
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент - это источник электрического тока, электролизер-потребитель электрического тока
|
|
|
|
2). В гальваническом элементе химическая энергия превращается в электрическую; образующиеся вещества менее энергоемки чем исходные.
В электролизере, наоборот, электрическая энергия превращается в химическую, Образующиеся вещества более энергоемки чем исходные. 3). В замкнутой гальванической цепи электрохимические процессы окисления и восстановления протекают самопроизвольно. В электролизере электрохимические процессы окисления и восстановления идут только под внешним воздействием электрического тока, т.е. самопроизвольно эти процессы не протекают.
Сравнительная схема, иллюстрирующая принцип действия гальванического элемента (а) и электролизёра (б).





 а)
а)
 | 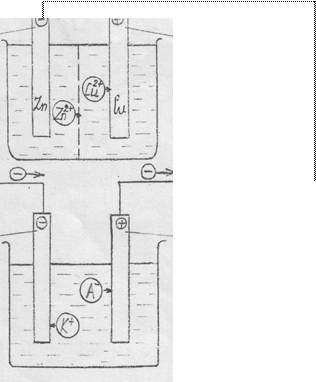 | ||


Анод Катод
окисление восстановление
(отдача электронов) (приём электронов)
Zn → Zn2+ + 2е Сu2+ + 2е → Сu0
 |  |
б)

 Катод Анод
Катод Анод
восстановление окисление
(приём электронов) (отдача электронов)
К+ + е → К А- → А + е
(К+ - катион) (А- - анион)
4). В гальваническом элементе отрицательный электрод – анод, а положительный электрод – катод.
В электролизере, наоборот, отрицательный электрод - катод, а положительный электрод – анод.
Иметь в виду: 1). Как в гальваническом элементе так и в электролизере на отрицательном электроде создается избыток электронов, на положительном электроде.- недостаток электронов, т.е. обозначение «отрицательный» и «положительный” всегда относится к полюсам источника тока.
2). Термины “катод” и “анод” связаны только с направлением потока электронов через электроды, которые представляют собой материалы с электронной проводимостью и на поверхности которых происходит переход электрического тока от проводников 1 рода к проводнику 11 рода (электролиту).
|
|
|
Катод – это электрод, через который поток электронов входит в гальванический элемент или электролизер и на котором реагирующие частицы восстанавливаются из-за наличия избытка электронов.
Анод – это электрод, через который поток электронов выходит из гальванического элемента или электролизера и на котором реагирующие частицы окисляются вследствие недостатка электронов.
В электролизере на отрицательном электроде – катоде протекает восстановление, а на положительном электроде – аноде – окисление.
Например: Na+ + e → Na0 2CI- - 2e → CI2
В гальваническом элементе на положительном электроде – катоде протекает восстановление, а на отрицательном электроде - аноде - окисление.
Например: Cu2+ + 2e → Cu0 Zn0 – 2e → Zn2+
30.3 Электролиз в водном растворе.
При электролизе водных растворов электролитов в электродных полупроцессах может принимать участие, кроме электролита, вода. В результате электролитического разложения Н2О на катоде образуется Н2, а на аноде – О2.
Н+ + е → Н0 Н0 + Н0→ Н2
2ОН- - 2е → О + Н2О О0 + О0 → О2
Поскольку Н2О – слабый электролит, в ионных уравнениях положено записывать не ее ионы, а молекулы. Именно молекулы (а не большое количество ионов Н+ и ОН- ) в основном участвуют в полупроцессах на электродах:
Восстановление на катоде: 2Н2О + 2е → Н2 + 2ОН-
Окисление на аноде: 2Н2О – 4е → О2 + 4Н+
Окончательное суммарное уравнение электролиза Н2О следует записать так: 2Н2О 2Н2 + О2
При электролизе водных растворов электролитов в катодном восстановлении и анодном окислении в принципе могут участвовать ионы воды (Н+ и ОН-) и ионы электролита. Одноимённые по знаку ионы воды и электролита конкурируют между собой и разряжаться будет тот катион (на катоде) и тот анион (на аноде), которому отвечает более низкое по значению напряжение разряда.
|
|
|
При электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих ионы F- и кислородсодержащих кислот (SO4, NO3, PO4 ) выделяется кислород, т.е. происходит окисление воды;
б) при электролизе растворов солей, содержащих кислотные остатки бескислородных кислот (Cl-, Br -, J- и другие) происходит их окисление с выделением свободных галогенов и т.п;
в) при электролизе растворов, содержащих анионы органических кислот, происходит процесс:
2RCOO- - 2е → R—R + 2CO2
2. На катоде образуются следующие продукты:
а) при электролизе растворов солей, содержащих ионы металлов, расположенных в ряду напряжений левее Al3+, на катоде происходит восстановление воды с выделением водорода;
б) если катион металла расположен правее водорода, то на катоде происходит его восстановление с выделением металла;
в) при электролизе растворов солей, содержащих ионы металлов, расположенных в ряду напряжений между Al3+ и Н+, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода, т.е. продуктами электролиза являются и водород, и металл.
Продумайте, как будет протекать процесс электролиза растворов следующих солей: CuSO4, KCl, KNO3, CuJ2.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 881; Нарушение авторских прав?; Мы поможем в написании вашей работы!