
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы электролиза
|
|
|
|
Электролиз с растворимым анодом.
При электролизе на аноде могут происходить различные процессы в зависимости от того, состоит ли анод из металла, переходящего в раствор, или из инертного материала. Для изготовления инертных электродов чаще всего используют Рt, реже Ir, Au или Та. Весьма инертными являются угольные электроды.
Многие технологические методы основаны на непосредственном химическом участии анодов (помимо физического переноса электронов) в элекрохимическом процессе. Такие методы называются электролизом с растворимым анодом.
В качестве растворимых анодов могут быть Сu, Ni, Cd, AI и другие металлы. При этом виде электролиза анод – металл окисляется (растворяется), образующиеся катионы металла перемещаются к катоду и на нем восстанавливается до металла. Т.о. металл растворимого анода осаждается на катоде.
Электролиз с растворимым анодом имеет важное техническое значение, например он широко применяется для очистки металлов – электрорафинирования. При прохождении тока в электролизере идут следующие электродные полупроцессы.
Окисление на аноде Сu (черновая) – 2е → Сu2+
Восстановление на катоде Сu2+ + 2е → Сu (особо чистая)
При электролизе с растворимым анодом на аноде не выделяется газообразный кислород.
На основании экспериментальных данных в 1833-1834г.г. Фарадей установил соотношение между количеством электричества, прошедшего через раствор, и количеством вещества, прореагировавшего при этом на электродах:
1 закон Фарадея – количество вещества, прореагировавшего при электролизе на электродах, прямо пропорционально количеству электричества, прошедшего через раствор.
m = KQ = KIτ, где: (6.15)
т – масса прореагировавшего на электродах вещества, кг
|
|
|
Q – количество электричества, прошедшего через раствор, Кл
I – сила тока, А
τ – продолжительность процесса электролиза, с
Коэффициент К в 6.15 – это электрохимический эквивалент вещества, равный количеству прореагировавшего на электродах вещества под действием 1кл электричества.
Из 6.15: К = (6.15а)
(6.15а)
Электрохимический эквивалент вещества зависит только от природы вещества и служит его индивидуальной характеристикой.
Более полное описание влияния природы вещества на процесс электролиза дает 11 закон Фарадея: - количества различных веществ, прореагировавших при электролизе на электродах под действием одинакового количества электричества, пропорциональны их химическим эквивалентам .
Воспользовавшись выражением (6.15) для веществ 1,2,3 и т.д., подвергаемых электролизу одинаковыми количествами электричества Q, согласно 11 закону Фарадея находим:
т 1 = п Э1 = К1Q; т 2 = п Э2 = К2Q; т 3 = п Э3= К3Q и т. д.,
где Э – эквивалентная масса (сейчас она чаще обозначается mэ).
Отсюда следует:
 (6.16)
(6.16)
Для электролиза n моль эквивалентов вещества расходуется Q кулонов электричества.
Разделив равенство (6.16) на n, получим:
 (6.16а)
(6.16а)
Это значит, что для электролиза 1 моль эквивалентов любого вещества расходуется одно и то же количество электричества. Это количество электричества было названо числом Фарадея (F). Число Фарадея равно 96500 Кл/моль (точно 96487). Воспользовавшись выражениями (6.15) и (6.16а) можно получить обобщённое уравнение, объединяющее оба закона Фарадея:
m =  (6.17)
(6.17)
Это уравнение можно записать и через объём, если в процессе электролиза принимают участие вещества в газообразном состоянии.
V =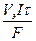 (6.17а)
(6.17а)
где Vэ – эквивалентный объём.
Однако законы Фарадея на практике несколько искажаются, вследствие чего результаты расчёта и опыта отличаются. Для устранения этого различия в
|
|
|
уравнение (6.17) вводят поправочный коэффициент η (эта), называемый выходом по току:
m практ. = 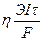 (6,17б)
(6,17б)
Выход по току характеризует ту часть от теоретического количества вещества, которая действительно прореагировала при электролизе на электродах, т.е. η представляет собой к.п.д. электролизёра:
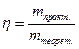 (6.18)
(6.18)
Обычно к.п.д.‹ 1, но при электролизе солей Pt. Au, Ag, Ni и в ряде других случаев η =1.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 509; Нарушение авторских прав?; Мы поможем в написании вашей работы!