
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особливості приготування робочих титрованих розчинів кислот і лугів
|
|
|
|
Приклади практичних визначень методом нейтралізації
ЛЕКЦІЯ 18
Приклади практичних визначень методом нейтралізації
План
1. Особливості приготування робочих титрованих розчинів кислот і лугів.
2. Визначення кальцинованої, харчової та каустичної соди та їх сумішей.
3. Визначення карбонатної твердості води.
4. Титриметричне визначення кислотності рідких вуглеводневих палив.
Для титрування можна застосовувати соляну, сірчану або азотну кислоти. Проте частіш за все користуються соляною кислотою. Вона е більш сильною кислотою, ніж сірчана, і перехід забарвлення індикатора в цьому випадку є більш чітким.
Робочий титрований розчин HCl неможливо приготувати безпосереднім розведенням допевного об'ему відміряної або зваженої кількості концентрованої соляної кислоти (ρ = 1.19 г/см3, (ω = 37%). Це пов'язано з тим, що така кислота летка і визначення її концентрації за густиною є неточним. Отже, взяти iї точну наважку неможливо. Тому готують розчин приблизної концентрації, а потім уточнюють її за допомогою вихідних (стандартних, установчих) речовин. Методика її приготування викладена у методичних вказівках.
Для установки нормальності розчину соляної кислоти частіш за все застосовують буру (тетраборат натрію Na2B2O7·10H2O ), рідше безводну соду Na2CO3. Недоліком останньої є невелика молярна маса і помітна гігроскопічність.
При нейтралізації бури соляною кислотою відбуваеться реакція:
Na2B2O7 + H2O +2НСl = HBO2 + 2NaCl
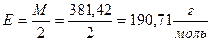
Отже, для приготування, наприклад, 250мл точного 0,1н розчину бури необхідно взяти наважку:
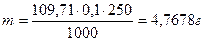
Як видно з рівняння реакції, в точці еквівалентності розчин повинен містити тільки хлорид натрію і боратну кислоту і мати наступний pH(використовуемо рівняння для слабкої кислоти):
|
|
|

З таблиці індикаторів видно, що найбільш придатні для даного титрування метилчервоний (рТ = 5). Прийнятним є і метилоранжевий (рТ = 4), хоча в цьому випадку відбуваетьея деяке перетитрування (Ha 1 - 2 краплі) для досягнення більш кислого середовища, що при дуже відповідальних аналізах може бути враховано за результатом так званого „сліпого" досліду.
В якості робочих розчинів основ звичайно застосовують розчини гідроксидів калію і натрію. Останній має деякі переваги (його легше отримати вільним від домішок карбонатів), тому застосовуеться частіше.
Ідкі луги нe мають властивостей вихідної речовини: вони гігроскопічні і легко реагують з вуглекислим газом повітря. Тому спочатку готують приблизно 0,1н розчин NaOH або КОН, а точну концентрацію встановлюють по вихідним речовинам, якими можуть бути щавлева кислота або титрований розчин соляної кислоти.
Під час приготування і зберігання розчинів лугів слід здійснювати заходи по запобіганню утворення карбонатів з СО2 повітря. Це і використання дистильованої води, вільної Big СО2 (He більше 1,5·10-5моль/л) і захист розчинів за допомогою хлоркальціевих трубок з натронним вапном (NaOH + Ca(OH)2), яке поглинае вуглекислий газ повітря.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1683; Нарушение авторских прав?; Мы поможем в написании вашей работы!