
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Префікси і суфікси для позначення деяких характеристичних груп
| Характеристична група | Префікс | Суфікс |
(С)OOH*
СООН
SO3H
(С)H O
СH O
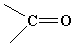 OH
SH
NH2
OH
SH
NH2
| карбокси сульфо- оксо- форміл- оксо- гидрокси- мерканто- аміно- | -ова кислота -карбонова кислота -сульфокислота -аль -карбальдегід -он -ол -тіол -амін |
| NO2 OR F, Cl, Br, I ( Hal) | нітро- алкокси- фтор-, хлор-, бром-, йод- (галоген-) | |
· Атом карбону, що заключений в дужки, входить до складу головного карбонового ланцюгу.
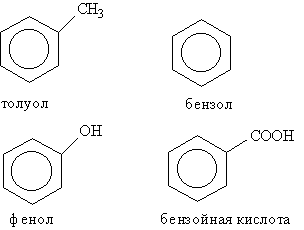
Як видно із таблиці, деякі характеристичні групи, а саме галогени, нітро- і алкоксигрупи, відображені в загальній назві тільки у вигляді префіксів, наприклад бромметан, етоксиетан, нітробензол. Нумерацію атомів вуглецю в головному ланцюгу починають з того його кінця, ближче до якого знаходиться старша група. В групі циклічних вуглеводнів особливо виділяються ароматичні вуглеводні, для яких характерна наявність в молекулі бензольного кільця. Деякі найбільш відомі представники ароматичних вуглеводнів та їх похідні мають тривіальні назви, дозволені правилами IUРАС: бензол, толуол, фенол, бензойна кислота.
Утворення назви органічної сполуки. Основу назви сполуки складає корінь слова, яке позначає насичений вуглеводень з тим же самим числом атомів, що і головний ланцюг(мет-, ет-, проп-, бут-, пент-, гекс- і т.д.). Після цього йде суфікс, що характеризує ступінь насиченості, -ан, якщо в молекулі немає кратних зв”язків, -ен при наявності подвійних зв”язків та –ин для потрійних зв”язків (наприклад ентан, пентен, пентин). Якщо кратних зв”язків в молекулі декілька, то в суфіксі зазначають число таких зв”язків: -діен, -триен, а після суфіксу обов”язково арабськими цифрами вказується положення кратного зв”язку (наприклад, бутен-1, бутен-2, бутадіен-1,3):
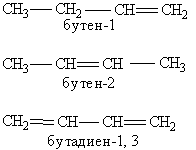
Далі в суфікс виноситься назва найстаршої характеристичної групи в молекулі і відмічається її положення цифрою. Інші замісники зазначають за допомогою приставок. Положення замісника відображається цифрою перед приставкою, наприклад: 3-метил; 2-хлор і т.п. Якщо в молекулі є декілька однакових замісників, то перед назвою відповідної групи їх кількість вказують словом (діметил-. трихлор- і т.д.). Вуглеводневі радикали мають свої назви.
Насичені вуглеводневі радикали:
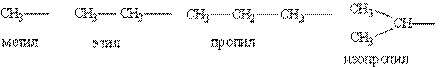

Ненасичені вуглеводневі радикали:

Ароматичні вуглеводневі радикали:
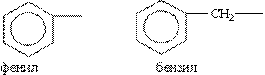
В якості прикладу наведемо наступну сполуку: 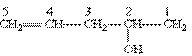
1) Вибір ланцюгу однозначний; отже, корінь слова – пент; далі йде суфікс – ен, який вказує на наявність кратного зв”язку; 2) порядок нумерації забезпечує старшій групі (-ОН) найменший номер; 3) повна назва сполуки закінчується суфіксом, що означає старшу групу (в даному випадку суфікс –ол вказує на наявність гідроксильної групи); положення подвійного зв”язку і гідроксильної групи вказується цифрами. Отже, наведена сполука називається пентен-4-ол-2.
Тривіальна номенклатура представляє собою сукупність несистематичних назв органічних сполук, що виникли історично (приклад: ацетон, оцтова кислота, формальдегід і т.д.).
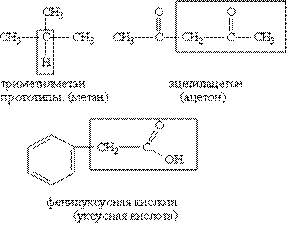
Раціональна номенклатура дозволяє будувати назву речовини на основі її структури з більш простою сполукою, вибраною в якості прототипу. Спосіб такої побудови ілюструють такі прик-лади:
Ізомерія. Вище було показано, що здатність атомів карбону до утворення чотирьох ковалентних зв”язків, в т.ч. і з іншими атомами карбону, відкриває можливість існування декількох сполук одного елементного складу – ізомерів. Всі ізомери поділяють на два великих класи – структурні ізомери і просторові ізомери. Структурні ізомери – ті, що відповідають різним структурним формулам органічних сполук (з різним порядком сполучення атомів). Просторові ізомери мають однакові замісники у кожного атома карбону і відрізняються лише їх взаємним розташуванням у просторі. Структурні ізомери. Згідно з наведеною вище класифікацією органічних сполук за типом, серед структурних ізомерів виділяють три групи: 1) сполуки, що вміщують різні функціональні групи і відносяться до різних класів органічних сполук:
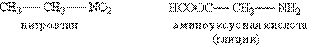
2) сполуки, що відрізняються карбоновими скелетами:
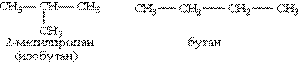
3) сполуки, що відрізняються розташуванням замісника або кратного зв”язку в молекулі:
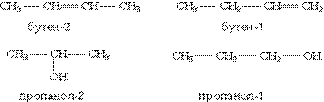
Просторові ізомери (стереоізомери). Стереоізомери можна розподілити на два типи: геометричні ізомери і оптичні ізомери.
Геометрична ізомерія характерна для сполук, які мають подвійний зв”язок, або цикл. В таких молекулах часто можливо провести умовну площину таким чином, що замісники у різних атомів карбону можуть опинитися з однієї сторони (цис-) або з різних сторін (транс-) цієї площини. Якщо зміна орієнтації цих замісників відносно площини можлива лише за рахунок розриву одного з хімічних зв”язків, то говорять про наявність гометричних ізомерів. Вони відрізняються своїми фізичними і хімічними властивостями.
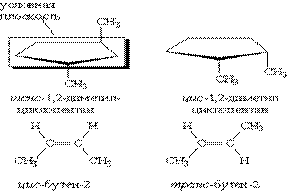
Оптичні ізомери - молекули, зеркальні відображення яких несумісні одне з одним. Така властивість притаманна молекулам, що мають асиметричний центр – атом карбону, зв”язаний з чотирма різними замісниками. Наприклад, у вигляді двох оптичних ізомерів існує молекула молочної кислоти СН3СН(ОН)—СООН, яка містить один асиметричний центр.
Взаємний вплив атомів в молекулі. Молекула органічної сполуки представляє собою сукуп-ність атомів, зв”язаних певним чином, як правило, ковалентними зв”язками. При цьому, зв”язані атоми можуть відрізнятися за величиною електронегативності. Від величини останньої в значній мірі залежать такі найважливіші характеристики зв”язку, як полярність і міцність (енергія утво-рення). В свою чергу, полярність і міцність зв”язків в молекулі визначають можливості молекули вступати в ті чи інші хімічні реакції. Електронегативність атому карбону залежить від стану його гібридизації. Це зв”язано з долею s -орбіталі в гибридній орбіталі: вона менше у sp3 - і більше у sp2- і sp- гібридизованих атомів. Всі атоми, що складають молекулу, існують у взаємозв”язку і знахо-дяться під взаємним впливом. Цей вплив передається в основному через систему ковалентних зв”язків за допомогою так званих електронних ефектів.
Електронними ефектами називають зміщення електронної щільності в молекулі під впли-вом замісників. Атоми, що зв”язані полярним зв”язком, несуть часткові заряди, які позначають грецькою літерою “дельта”(d). Атом,який „відтягує” електронну щільність s -зв”язку у свій бік, придбає негативний заряд d- . При розгляданні пари атомів з ковалентним зв”язком, більш електро-негативний атом, називають елетроноакцептором. Його партнер по s -зв”язку відповідно буде мати рівний за величиною дефіцит електронної щільності, тобто частковий позитивний заряд d+ і буде називатись електронодонором. Зміщення електронної щільності по ланцюгу s -зв”язків називається індуктивним ефектом і позначується I. Індуктивний ефект передається із згасан-ням. Напрям зміщення електронної щільності всіх s - зв”язків позначують прямими стрілками. В залежності від того, чи віддаляється електронна щільність від атому карбону, що розглядається, чи наближається до нього, індуктивний ефект називають негативним (-I) або позитивним (+I). Знак і величина індуктивного ефекту визначаються різницею в електронегативності між атомом карбону, який розглядається, і групою, що його викликає. Електроноакцепторні замісники, тобто атом чи група атомів, які зміщують електронну щільність s - зв”язку від атому карбону, виявляють нега-тивний індуктивний ефект (- І-ефект). Електронодонорні замісники, тобто атом чи група ато-мів, які зміщують електронну щільність до атома карбону, проявляють позитивний індуктивний ефект (+ І-ефект). +I-ефект проявляють аліфатичні вуглеводневі радикали, тобто алкільні ради-кали (метил, етил, і т.д.). Більшість функціональних груп проявляють -I-ефект: галогени, аміно-група, гідроксильна, карбонільна, карбоксильна групи. Індуктивний ефект виявляється і у випадку, коли зв”язані атоми карбону різні за станом гібридизації. Так, в молекулі пропена метильна група проявляє +I-ефект, оскільки атом карбону в ній знаходиться в sp3- гібридному стані, а sp2- гібри-дизований атом (при подвійному зв”язку) виступає в ролі электроноакцептора тому, що має більш високу електронегативність:
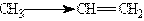
При передачі індуктивного ефекту метильної групи на подвійний зв”язок в першу чергу її вплив відчуває більш рухливий p -зв”язок. Вплив замісника на розподілення електронної щільності, яка передається по p -зв”язкам, називають мезомерним ефектом (М). Цей ефект також може бути негативним чи позитивним. В структурних формулах його відображають зігнутою стрілкою, яка починається у центра електронної щільності і завершується в тому місці, куди зміщується електронна щільність. Наявність електронних ефектів веде до перерозподілу електронної щіль-ності в молекулі і появі часткових зарядів на окремих атомах. Це визначає реакційну здатність молекули.
|
|
Дата добавления: 2014-01-04; Просмотров: 1557; Нарушение авторских прав?; Мы поможем в написании вашей работы!