
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ 2. Химическая энергетика. Тепловые эффекты химических реакций
|
|
|
|
Технико-экономический уровень химического производства определяется совокупностью технико-экономических показателей, среди них особенно важны такие как выход готового продукта и степень превращения сырья, селективность и скорость химического процесса, протекающего в реакторе.
Под химическим процессом в реакторе понимают химическую реакцию и сопутствующие ей явления массо- и теплопереноса. В химическом реакторе можно условно выделить три зоны: зону подвода реагирующих веществ в зону химических реакций, зону химических реакций и зону отвода продуктов из зоны химических реакций. В первой и третьей зонах реактора протекают физические процессы подвода и отвода веществ, подчиняющиеся общим законам массопередачи. Во второй зоне химического реактора протекает ряд химических реакций, каждая из которых характеризуется скоростью (кинетический фактор) и состоянием равновесия в системе (термодинамический фактор). Следовательно, для оценки протекающих в этой зоне явлений необходимо исследовать влияние различных факторов на скорость химической реакции и полноту протекания ее, т. е. состояние равновесия в системе.
Основные технологические показатели 1 и 3 третьей зоны химико-технологического процесса. Выход готового продукта определяется как отношение массы полученного продукта к массе сырья, затраченного на его производство. Для одностадийного процесса, протекающего по схеме А®В выход равен 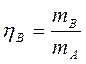 (1)
(1)
Если в основе процесса лежит химическая реакция, описываемая конкретным уравнением, то для необратимых реакций выход определяется как отношение массы, полученной на практике mВ(пр) к массе, теоретически возможной по стехиометрическому уравнению mВ(теор).
|
|
|
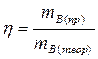 (2)
(2)
Выход для обратимой реакции определяется как отношение практически полученной массы продукта к максимально возможной массе его, которая может быть получена в данных условиях производства.
Степенью превращения сырья называется отношение массы сырья, вступившего в химическое превращение за время t, к исходной массе его (mао).
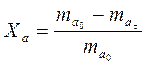 (3)
(3)
где mat - количество сырья, не вступившего в реакцию превращения за время t.
Выход продукта и степень превращения выражаются в долях единицы или процентах. Для оценки состояния равновесия в реакторе обычно используют равновесную степень превращения (равновесный выход продукта), который определяется из равновесного закона действующих масс.
Одной из важнейших характеристик всякого технологического процесса является его энергетика. Основным признаком любой химической реакции является выделение или поглощение теплоты, происходящее при химических превращениях одних веществ в другие. Реакции, протекающие с выделением теплоты, носят название экзотермических реакций, а сопровождающиеся поглощением теплоты - эндотермических. К первым относятся, как правило, все реакции соединения, а типичными реакциями второго типа являются реакции разложения.
Количество теплоты, выделяющейся или поглощающейся при химической реакции, называют тепловым эффектом реакции. Обычно его выражают в килоджоулях (кДж).
Строго говоря, теплота, выделяемая или поглощаемая в результате химического превращения, является своеобразным «участником» химической реакции. Поэтому для соблюдения закона сохранения и превращения энергии количество теплоты, сопровождающее химическую реакцию, должно быть включено в ее уравнение. Уравнения химических реакций, в которых приводятся значения тепловых эффектов, называют термохимическими.
Знак «+» перед значением теплового эффекта в правой части уравнения означает, что теплота выделяется, в то время как для эндотермических реакций тепловой эффект должен быть взят со знаком «-», если он указан в правой части уравнения.
|
|
|
Следует отметить, что значение теплового эффекта в термохимическом уравнении строго соответствует количествам реагентов и продуктов, определяемым стехиометрическими коэффициентами. Наиболее часто встречающейся формой записи термохимических уравнений является такая, согласно которой образуется один моль продукта реакции. Например, тепловой эффект реакции взаимодействия водорода с кислородом
Н2 + 1/2О2 = Н2О(г) + 242 кДж
должен быть удвоен для реакции, в которой используются удвоенные коэффициенты:
2Н2 + О2 = 2Н2О(г) + 484 кДж
В чем же причина поглощения или выделения теплоты при химических превращениях? Каждое тело обладает определенным запасом внутренней энергии. Внутренняя энергия включает все виды энергии, характеризующие тело: энергию движения молекул относительно друг друга, энергию движения электронов и атомов в молекуле и т. д. Запас внутренней энергии каждого тела зависит от природы тела, его массы и от условий, в которых оно находится.
Суммарная внутренняя энергия продуктов реакции в общем случае отличается от суммарной внутренней энергии реагентов, так как в процессе реакции происходит изменение молекулярного состава вещества, а, следовательно, и изменение межатомных расстояний в продуктах реакции по сравнению с исходными реагентами. Одновременно происходит и перестройка электронных оболочек атомов взаимодействующих молекул. Эта суммарная разница как раз и соответствует тепловому эффекту реакции. Очевидно, что он, подобно внутренней энергии, должен зависеть от условий, в которых находятся реагенты и продукты.
Чтобы иметь возможность сравнивать различные химические реакции и производить термохимические расчеты, необходимо относить значения тепловых эффектов к одному и тому же состоянию исходных продуктов и реагентов. В качестве такого состояния, называемого стандартным, обычно выбирают температуру 298К (25°С) и давление 105Па (а также концентрацию 1 моль/л для растворов).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 522; Нарушение авторских прав?; Мы поможем в написании вашей работы!