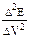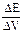КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрическое титрование
Метод разработан в 1893 году Р. Берендом.
Зависимость равновесного потенциала индикаторного электрода от состава раствора, описываемую уравнением Нернста, можно использовать для нахождения конечной точки титрования. Для потенциометрического титрования необходимо иметь систему электродов (индикаторный, электрод сравнения); потенциометр; исследуемый раствор и титрант, взаимодействующий только с определяемым ионом.
Титрант добавляют точно известными порциями и после этого измеряют потенциал. Из экспериментальных данных методом численной интерполяции можно найти объем титранта, затраченный на достижение точки эквивалентности.
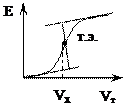
| По полученным данным можно построить интегральную кривую. | ||||||||
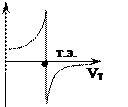 
| Если скачка нет (например, слабая кислота титруется слабым основанием, или растворы разбавлены) применяют дифференциальную форму кривой титрования (в виде первой производной). Определение объема титранта по дифференциальной кривой значительно точнее, чем по интегральной.
Возможно определение объема титранта по второй производной. В точке эквивалентности вторая производная потенциала по объему равна нулю. |
Выбор индикаторных электродов зависит от природы определяемых ионов и типа химической реакции. В методе косвенной потенциометрии применяют реакции кислотно-основного и окислительно-восстановительного взаимодействия, комплексообразования и осаждения. В табл. 7 приведены некоторые варианты выбора электродов при потенциометрическом титровании. В качестве электродов сравнения, как правило, применяют насыщенные электроды II рода.
Таблица 7
Варианты потенциометрического титрования
| Тип реакции | Измеряемая величина | Электроды | Определяемые вещества | |
| Индикаторный | Сравнения | |||
| Протолитометрия | рН | рН-стеклянный, хингидронный | Насыщенные электроды II рода (хлоридсеребряный) | Кислоты, основания, соли |
| Редоксиметрия | Е | Индифферентные I рода (платиновый) | Окислители, восстановители | |
| Комплексонометрия | рМе | Ме-селективные | Меn+; n > 1 | |
| Осаждение | рАg, pCl, рI, рBr | Ионоселективные; ненасыщенные II рода; серебряный | Ионы, образующие осадки |
|
|
Дата добавления: 2014-01-04; Просмотров: 896; Нарушение авторских прав?; Мы поможем в написании вашей работы!