
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Генетична інженерія тварин
|
|
|
|
Теоретичні та методичні основи генетичної інженерії тварин розроблені значно менше, ніж мікроорганізмів і рослин. Видоспецифічність об’єктів для перенесення сторонніх генів в геном тварин та механізмів генетичної модифікації пов’язана зі складністю структурної організації і функціонування тварин, наявністю хромосомної обумовленості статі, специфічністю реалізації репродуктивної функції та ембріонального розвитку.
Існують різні модельні системи генетичної інженерії тварин, розроблені на модельних об’єктах: нематоді (Caenorhabditis elegans), дрозофілі (Drosophila melanogaster), миші (Mus musculus) та деяких інших.
У нематоди рекомбінантна ДНК за допомогою шприцу або мікропіпетки ін’єктується безпосередньо в організм тварини. Для успішного проведення генетичної трансформації необхідне знання репродуктивної біології нематоди. Гонада нематоди представляє собою синцитій – багатоядерну клітину. Синцитій нематоди містить більше 100 ядер на різних стадіях. Ядра в одній частині синцитію ще не вступили в мейоз, в іншій містяться ядра, що вже завершили мейоз, є гаплоїдними і можуть приймати участь у заплідненні. Таким чином, якщо рекомбінантна ДНК вводиться в синцитій, то одразу більше 100 ядер потрапляють під вплив трансформуючої ДНК. Деякі з них поглинають ДНК. Зазвичай стороння ДНК формує або багатокопійні екстрахромосомні утворення, тобто присутня в ядрі поза межами хромосом. Рідко трансгени вбудовуються в хромосому ектопічно, часто багатокопійно.
Технологія генетичної трансформації миші розроблялася для потенційного використання у ссавців, в тому числі людини. Існують дві стратегії генетичної трансформації для миші.
Перша – це ектопічні вставки, коли трансгени потрапляють у випадкові місця геному, зазвичай багатокопійно. Для виконання генетичної трансформації рекомбінантна ДНК шляхом мікроін’єкції вводиться в ядро зиготи. Далі декілька оброблених зигот підсаджуються в матку, де розвивається плід. У кожному випадку трансген вбудовується в різні хромосоми або в різні місця однієї хромосоми, що призводить до розщеплення за трансгеном в потомстві. Такий підхід має деякі проблеми, пов’язані з порушенням експресії трансгена внаслідок ефекту положення та з інших причин, але стратегія ектопічних вставок доволі ефективна і не трудомістка.
|
|
|
Друга стратегія – таргетинг генів. За цієї стратегії трансгенна послідовність вставляється у місце, зайняте гомологічною послідовністю в геномі, тобто трансген заміщує власний ген. Ця стратегія дозволяє елімінувати або модифікувати функцію, яка кодується певним геном організму. Таргетинг генів доцільно застосовувати, коли потрібно інактивувати мутантний алель або виправити його на алель дикого типу. Виправлення мутантного алеля на алель дикого типу відбувається шляхом генного заміщення. При цьому трансген однокопійно вбудовується в свій локус на відповідній хромосомі. Для миші таргетинг генів здійснюють в ембріонально-стовбурових клітинах. Ембріонально-стовбурові клітини здатні розвиватися в клітини будь-якого типу, в тому числі і в клітини зародкової лінії. Після генетичної трансформації ембріонально-стовбурових клітин на селективних середовищах з безлічі трансформованих відбирають ті клітини, де вставка відбулася шляхом генного заміщення, тобто алель дикого типу замістив собою мутантний алель цього ж гена. Далі відселектовані трансформовані ембріонально-стволові клітини ін’єктують у зародок на ранніх стадіях розвитку. Дорослі особини, які виросли з таких зародків, схрещують з нормальними мишами. Отримане потомство є химерним, оскільки організм має певні тканини від оригінальних, нетрансгенних особин і деякі від трансгенних ембріонально-клітинних ліній. Хімерні миші далі схрещуються з їх сибсами для отримання гомозиготного потомства з нокаутованою (knockout), тобто ін активованою копією кожного гена. Мишей, які містять цільовий трансген в кожній клітині, ідентифікують молекулярно-генетичними методами аналізу. Методика таргетингу генів має важливе значення для генної терапії, сутність якої як раз і полягає у заміні мутантного алеля алелем дикого типу шляхом генного заміщення.
|
|
|
Загальна схема отримання трансгенних ссавців у теперішній час добре розроблена. Вона відбувається шляхом мікроін’єкції сторонньої ДНК у яйцеклітини або ранні ембріони. А. И. Божков (2008) виділяє наступні стадії введення розчину рекомбінантної ДНК та отримання трансгенних ссавців:
а) підготовка тварини та видалення яйцеклітин або ембріонів;
б) мікроін’єкція сторонньої ДНК в пронуклеус;
в) пересадка ін’єктованих ембріонів до яйцеводів (якщо використовується проміжне культивування) або в матку синхронізованих сурогатних матерів;
г) народження трансгенних тварин;
д) скринінг потомства на наявність трансгена.
Для трансформації тварин шляхом мікроін’єкції використовують запліднені яйцеклітини на стадії двох пронуклеусів або двоклітинні ембріони. Тільки в такому разі можна отримати тварин, у яких і в генеративних, і в соматичних клітинах міститися трансгени.
Для тварин відомо, що рекомбінантні молекули ДНК в лінійній формі інтегрують трансген до ДНК реципієнта в кілька разів краще, ніж кільцеві молекули ДНК. Вбудовування векторних послідовностей ДНК разом з трансгеном знижує інтенсивність його експресії в 1000 разів. З цієї причини за допомогою специфічних рестриктаз кільцеві молекули ДНК переводять в лінійну форму та видаляють векторні послідовності.
Концентрація розчину ДНК для мікроін’єкцій повинна складати 1-2 пг ДНК/мл. Це відповідає 200-400 копіям ДНК, якщо одна копія містить 5000 пар нуклеотидів (розмір середнього гена). За дотримання таких умов частота інтеграції ДНК в геном складає 20-40%. ДНК, введена до пронуклеусу шляхом мікроін’єкції, інтегрується лише в один сайт у вигляді тандемних послідовностей.
|
|
|
Для отримання запліднених яйцеклітин перед обробкою їх розчином рекомбінантної ДНК використовують суперовуляцію. У теперішній час розроблені окремі схеми гормональної стимуляції суперовуляції, штучного запліднення та вимивання ембріонів для основних видів сільськогосподарських тварин.
Мікроін’єкції ДНК в запліднені яйцеклітини та ембріони проводять за обов’язкової візуалізації з використанням інвертованих або прямих мікроскопів з диференціальною інтерференційно-контрастною оптикою, яка
забезпечує достатнє розрішення мембран пронуклеусу. Мікроін’єкції проводять скляними ін’єкційними голками, які відтягують на мікроковальні у той же самий день. Скляні ін’єкційні голки виробляють зі стандартних товстостінних капілярів боросилікатного скла, зовнішній діаметр яких складає 1,0 мм, а внутрішній – 0,58 мм, кінчик повинен бути не менш 1 мкм. Мікроін’єкції проводять у краплях забуференого розчину Дульбекко. Наносять серію крапель діаметром 1,5 мм. Одна крапля представляє собою розчин ДНК для ін’єкцій. В підготовлені краплі пастерівською піпеткою вносять по дві запліднені яйцеклітини.
Запліднені яйцеклітини від суперовульованих спарених самиць культивують протягом 1 години в середовищі М16 з 10 % бичачим сироваточним альбуміном при 370 С и 5 % СО2 у повітрі. Відбирають яйцеклітини з пронуклеусами і переносять їх в краплину середовища РВ1. В мікрокапіляр набирають розчин ДНК з першої краплі. За допомогою маніпулятора орієнтують яйця так, щоб обидва пронулеуси були в фокусі. Чоловічий пронуклеус має більший розмір, ніж жіночий. Яйце утримують піпеткою, приклавши до спеціального шприцу від’ємний тиск. Капіляр вводять у чоловічий пронуклеус коротким різким уколом, щоб проколоти мембрану. Після введення розчину ДНК пронуклеус повинен збільшитися в об’ємі, пізніше він зменшиться до звичайних розмірів. Мікрокапіляр виводять з яйця. Після цього прооперовані яйця промивають 6-тю краплями середовища М16, яке містить 10 % бичачий сироваточний альбумін, і лишають на ніч у краплині М16 з 10 % бичачим сироваточним альбуміном при 370 С и 5 % СО2 у повітрі.
|
|
|
Для трансплантації ембріонів використовують псевдовагітних самиць, тобто самиць, спарених зі стерильними (вазектомованими) самцями. Ембріони з ін’єктованою ДНК трансплантують псевдовагітним самицям найчастіше у яйцепровід хірургічно. У крупної рогатої худоби використовують також пересадку ембріонів нехірургічним шляхом в матку реципієнта, в цьому разі ембріони культивують in vitro до стадії морули. Трансгенні ембріони розвиваються у матці сурогатної матері. Народження проходить або природнім шляхом, або застосовують кесаревий розтин.
Докази інтеграції трансгена у геном тварини отримують молекулярно-генетичними методами аналізу з використанням ДНК-гібридизації. Для цього отримують ДНК тварин, виконуючи біопсію хвоста. Схема методу передбачає обробку виділеної ДНК умовно-трансгенної тварини рестриктазою, яка вирізає саме трансген. Для цього використовують саме той вид рестриктази, яку застосовували для виділення трансгена з донорної ДНК. Для гібридизації з фрагментами рестрикції використовують ДНК-зонд, який представляє собою використаний для генетичної трансформації трансген. У разі успішної гібридизації з певним фрагментом ДНК можна стверджувати про успішне вбудовування трансгена в геном тварини. Разом з тим побічно перевірити присутність та експресію трансгена можливо за його фенотиповим проявом, тобто по набутою здатністю тварини до прояву певних якостей. Фенотиповий аналіз трансгенного потомства тим більш важливий, оскільки навіть присутній в геномі трансгенної тварини трансген може з певних причин не проявлятися фенотипово (мовчання трансгена) або не проявлятися в наступних поколіннях. Трансгенні тварини, отримані за успішної трансформації шляхом мікроін’єкції в яйцеклітину, зиготу або ранній ембріон, не є мозаїчними і при схрещуванні з нетрансгенними особинами передають трансген 50 % потомків.
Іншим способом отримання трансгенних тварин, окрім мікроін’єкцій, є використання ретровірусів. За використання ретровірусів як переносників ранні морули видаляють з оболонки, піддають короткочасному впливу інфекційним вірусом, в геном якого попередньо вбудовано трансген, і морула трансплантується псевдовагітним самицям. Трансгенні тварини, отримані із застосування ретровірусів завжди є мозаїками з одним сайтом інтеграції, оскільки інфікування відбувається на стадії 8-16 клітин. Використання ретровірусів є дуже зручним, коли необхідно виконати перенесення генів в клітини дорослого організму, наприклад, в клітини крові для виправлення генетичних дефектів. Перспективним є використання ретровірусів як векторів для вбудовування трансгенів у клітини зародкового шляху та стовбурові клітини ссавців і людини. Стовбурові клітини – це тотіпотентні соматичні клітини, здатні диференціюватися в будь-який тип клітин даного організму. Стволові клітини здатні після мітотичних поділів заміщувати загиблі клітини багатоклітинного організму.
Існують і інші способи доставляння трансгена до реципієнтних клітин, наприклад, метод електропорації клітин мікрочастинками золота, вкритих фрагментами ДНК, що містять трансген.
РОЗДІЛ 3. ДОСЯГНЕННЯ ТА ПЕРСПЕКТИВИ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ
ДОСЯГНЕННЯ ТА ПЕРСПЕКТИВИ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ МІКРООРГАНІЗМІВ ДЛЯ ПРОМИСЛОВОГО ВИРОБНИЦТВА БІОТЕХНОЛОГІЧНИХ ПРОДУКТІВ
Бактерії та гриби належать до груп мікроорганізмів, які широко використовуються як продуценти цінних біотехнологічних продуктів. Саме ці об’єкти стали першими генетично-модифікованими організмами, які набули практичного значення у виробництві. Об’єктами генетично-інженерних маніпуляцій серед мікроорганізмів є віруси, бактерії, гриби, мікроскопічні водорості та найпростіші. Біологічними об’єктами можуть бути і первинні метаболіти мікробного походження – ферменти, активність яких лежить в основі інженерної ензимології. Для промислової біотехнології у теперішній час найбільше значення мають результати генно-інженерних досліджень із введення у клітини сторонніх генів, одержаних з геномів інших організмів або синтезованих штучно, для зміни властивостей та ознак продуцентів.
Створення і використання трансгенних мікроорганізмів дозволяє проводити оптимізацію промислового одержання біотехнологічних продуктів, одержувати принципово нові цільові продукти, досліджувати структуру мікробних угруповань, інтенсифікувати дослідження з ДНК-систематики та ін. У подальших розділах наводяться механізми створення і приклади використання трансгенних мікроорганізмів для підвищення ефективності одержання біотехнологічних продуктів.
Перша рекомбінантна молекула ДНК була сконструйована П. Бергом у 1972 році. В ній фрагменти ДНК вірусу мавп ОВ40 і бактеріофагу λ були з’єднані з галактозним опероном E. coli. Подальші інтенсивні розробки технології рекомінантних ДНК призвели до створення численних генетично-трансформованих штамів мікроорганізмів, які становлять основу промислового виробництва продуктів різноманітного призначення. Це гормони, вакцини, ферменти, антибіотики та інші лікарські засоби, харчові домішки, пігменти і барвники, поверхнево-активні сполуки, біополімери для харчової, переробної, фармацевтичної та інших галузей промисловості. Завдяки генетичній інженерії отримані мікроорганізми зі зміненими властивостями для біодеградації ксенобіотиків, для застосування у гірничовидобувній промисловості, у сільському господарстві та інших сферах людської діяльності.
Першою розробкою у галузі генетичної інженерії мікроорганізмів, що вийшла на рівень промислового виробництва, була біотехнологія виробництва інсуліну.
Інсулін представляє собою поліпептидний гормон, молекула якого складається з двох ланцюгів – А (21 амінокислотний залишок) та В(30 амінокислотних залишків). Ланцюги А і В з’єднуються дисульфідними містками між амінокислотними залишками А7 і В7 та А20 і В19. Третій дисульфідний зв'язок з’єднує залишки у ланцюгу А між А6 і А11.
Інсулін в організмі людини синтезується в рибосомах β-клітин підшлункової залози у вигляді препрогормону з молекулярною масою 11,5 кД. Препрогормон в результаті обмеженого протеолізу послідовно перетворюється в ендоплазматичному ретикулумі та апараті Гольджі на прогормон (молекулярна маса 9 кД) та зрілий інсулін (молекулярна маса 5,7 кД). Головним фізіологічним стимулом секреції інсуліну з клітин підшлункової залози в екстрацелюлярний простір є збільшення концентрації глюкози в крові понад рівень фізіологічної норми (3,3 – 5,5ммоль/л).
Інсулін в організмі людини регулює перш за все обмін вуглеводів через стимуляцію транспорту глюкози, сприяння утилізації глюкози шляхом гліколізу, пентозофосфатного шляху та синтезу глікогену, гальмування процесу глюконеогенезу в печінці. Він також впливає на обмін ліпідів, амінокислот та білків, процеси клітинного росту та проліферації. Порушення синтезу, секреції інсуліну та реактивності інсулінових рецепторів призводить до захворювання на цукровий діабет, яке характеризується стійкою гіперглюкоземією – підвищеним вмістом глюкози в крові.
На Землі більше 60 млн. людей страждають на цукровий діабет. Розрізняють дві форми діабету:
- інсулінозалежний цукровий діабет, який розвивається внаслідок аутоімунного руйнування значної кількості секретуючих інсулін β-клітин підшлункової залози;
- інсулінонезалежний цукровий діабет, за якого у більшості хворих зберігаються β-клітини підшлункової залози, але порушені специфічні реакції клітин на дію інсуліну або регуляція його секреції під впливом збільшеної концентрації глюкози крові.
Значна доля хворих на цукровий діабет, перш за все на його інсулінозалежну форму, потребує регулярного введення інсуліну. Спершу спробою отримання інсуліну для ін’єкцій було використання тваринного інсуліну з підшлункової залози свиней та великої рогатої худоби. Але тваринний інсулін відрізняється від інсуліну людини за амінокислотною послідовністю, до того ж його виділення є дорогим, що обмежує фармацевтичне виробництво. Хімічний синтез інсуліну складається з 170 реакцій і є надто складним для масштабного промислового виробництва.
Роботи з одержання генно-інженерного інсуліну були розпочаті у 1976 році з хімічного синтезу синтетичних генів окремих поліпептидних ланцюгів інсуліну. Кожен з таких генів приєднували до 3'-кінця гену ферменту β-галактозидази у складі вектора pBR322, яким потім трансформували клітини E.coli. Трансформована кишкова паличка синтезувала гібридні білки, що складалися з ферменту β-галактозидази і А чи В ланцюгу інсуліну, приєднаного до нього через залишок метіоніну. Після обробки химерного білка бромціаном пептид звільнявся. Але утворення дисульфідних містків та формування функціонально активного білка не відбувалося. Більш продуктивним виявився інший підхід. Рестриктазний фрагмент мРНК, який кодує проінсулін, був використаний як матриця для отримання кДНК. Останню було клоновано у E.coli, що дало змогу одержати високоефективні продуценти інсуліну.
Наступним промисловим біотехнологічним продуктом на основі рекомбінантних ДНК став гормон росту людини – соматотропін. Цей гормон синтезується клітинами передньої долі гіпофізу і представляє собою поліпептидний ланцюг з 191 амінокислоти. Недостатність утворення цього гормону призводить до гіпофізарної карликовості з частотою 1 випадок на 5000 людей. Людський соматотропін є видоспецифічним. Фармацевтичні компанії виробляли його з трупного матеріалу, через що відбувався його частковий протеоліз. Продукти протеолізу призводять до утворення антитіл і швидко нейтралізують біологічну активність гормону.
Генно-інженерний соматотропін людського походження був отриманий у 1979 році Д. Гедделем зі співробітниками. Ген соматотропіну одержали у вигляді кДНК, синтезованої на мРНК з клітин гіпофізу людини методом зворотної транскрипції. Від отриманого гену рестрикційно відщеплювали фрагмент ДНК, що кодує 23 амінокислоти з N-кінця. На наступному етапі був приєднаний синтетично створений фрагмент гена, який вміщував кодони для недостатніх 23 амінокислот та стартовий кодон біосинтезу білка. Отриманий гібридний ген включали у вектор перед lac-промотором та ділянкою Шайна-Дальгарно, яка відповідає за зв’язування мРНК з рибосомою. Гібридний ген вводили в клітини E.coli, де він індукував синтез соматотропіну. Кінцевий вихід гормону росту людини склав 2,4 мкг/мл культури (100000 молекул гормону на клітину). Отриманий гормон на N-кінці поліпептидного ланцюгу утримував додатковий залишок метіоніну, однак мав достатню біологічну активність.
У 1982 році генно-інженерний гормон росту людини був одночасно отриманий в Інституті Пастера у Парижі та в Інституті молекулярної біології у Москві. З 1984 року після достатніх клінічних випробувань на токсичність фірма “Генетек” (Сан-Франциско) отримала дозвіл на промислове виробництво бактеріального соматотропіну.
Велика кількість гормонів і гормоноподібних регуляторних поліпептидів людини мають невеликі розміри. Їх синтез в бактеріальних клітинах неефективний, тому що чужорідні низькомолекулярні олігопептиди швидко розщеплюються протеолітичними ферментами клітин-продуцентів і виділити такі продуценти неможливо. Для отримання людських олігопептидів з використанням бактеріальних клітин був розроблений метод їх непрямої експресії. Суть цього метода полягає у штучному подовженні поліпептиду з наступним вищепленням гормонального продукту. Цим методом отримані наступні гормони та гормоноподібні поліпептиди.
Соматостатин – це гормон гіпоталамусу, його молекула складається з 14 амінокислотних залишків. Соматостатин подавляє виділення інсуліну та гормону росту людини. Перший синтез соматостатину генно-інженерним способом був здійснений Бойєром у 1977 році. Основними етапами генно-інженерного синтезу соматостатину були наступні. Спочатку було здійснено хіміко-ферментативний синтез гена з 52 пар нуклеотидів, з яких 42 складали структурний ген гормону, а інші слугували липкими кінцями. На наступному етапі за допомогою липких кінців ген соматостатину з одного кінця був приєднаний до плазміди pBR322, а з іншого – до бактеріального гена β-галактозидази E.coli. Між генами соматостатину і β-галактозидази був розміщений кодон метіоніну. Рекомбінантна ДНК була введена в E.coli, яка синтезувала відповідний химерний білок. Соматостатин відщеплювали від β-галактозидази бромціаном, який специфічно гідролізує пептидний зв'язок, утворений метіоніном. За даної технології вихід гормону склав 10000 молекул на клітину.
Гіпоталамічний рилізинг-фактор соматотропіну (СТГ-РФ) – інший олігопептид, який регулює ріст людини. Схема його синтезу була подібна до попередньої. Отриманий синтетичним шляхом ген СТГ-РФ з’єднали з плазмідним вектором pBR322 та геном β-галактозидази через метіоніновий кодон. Отримані трансформанти E.coli стали продуцентами химерного білка, з якого шляхом специфічного протеолізу відщеплювали СТГ-РФ.
β-ендорфін – олігопептид з 31 амінокислоти, слугує регулятором роботи нервової системи. Конструювання генно-інженерного β-ендорфіну включало
отримання шляхом зворотної транскрипції кДНК, яка кодує білок-попередник, що складається крім β-ендорфіну з β-ліпотропіну та іншого продукту. Біологічно активний β-ендорфін отримували шляхом специфічного протеолізу гібридного білка. Подібним шляхом проведено конструювання рекомбінантної ДНК та забезпечена експресія нейропептидів лейцин-енкефаліну та брадикініну людини у клітинах E.coli. 
Біотехнологія інтерферону. Інтерферони були відкриті в 1957 році у Національному інституті медичних досліджень у Лондоні. Було встановлено, що коли в організмі з'являються клітини, інфіковані вірусом, то у ньому утворюється фактор, здатний надавати інтактним клітинам стійкість до вірусної інфекції. Цей фактор перешкоджає (інтерферує) подальшому розмноженню вірусів в клітинах, а тому отримав назву інтерферон. Здатність утворювати інтерферони – важливий спосіб захисту організму від інфекції.
Інтерферони – видоспецифічні білки, які складаються з 146-166 амінокислотних залишків. Розрізняють три групи інтерферонів.
α-інтерферони (α-І) утворюються за дії вірусів на лейкоцити. Родина α-інтерферонів представлена простими білками, молекули яких мають два дисульфідних містки, кодується приблизно 20 генами.
β-інтерферони (β-І) з'являються за дії вірусів на фібробласти. Це глікопротеїди, число генів, що їх кодує не встановлено.
γ-інтерферони (γ-І) виробляються Т-лімфоцитами, за умови, коли в організмі існують спеціальні Т-клітини на певні вірусні антигени. γ-інтерферон представлений в організмі людини одним глікопротеїдом.
Інтерферони знайшли широке використання для лікування різних важких хвороб – гострого вірусного гепатиту, розсіяного склерозу, остеосаркоми, мієломи, лімфоми, меланоми, пухлин гортані, легень, мозку.
Механізм дії інтерферону полягає у тому, що інтерферон взаємодіє з клітинними рецепторами і ініціює транскрипцію двох структурних генів - 2', 5'-олігоаденілатситетази і протеїнкінази. Обидва ферменти проявляють свою активність у присутності дволанцюгових ДНК, які є продуктами реплікації вірусів. Фермент 2',5'-олігоаденілатситетаза каталізує синтез 2',5'-олігоаденілатів з АТФ. Останні активують рибонуклеазу І, яка здійснює деградацію мРНК та рРНК. Активована протеїнкіназа фосфорилює один із трьох факторів ініціації трансляції, IF2. Ці процеси призводять до інгібування як біосинтезу білка, так і розмноження вірусів в інфікованій клітині.
Для застосування у медицині потрібен людський інтерферон, оскільки він є видоспецифічним. Інтерферон отримують з крові людини (з 1 л крові можна виділити 1 мкг інтерферону, тобто приблизно, одну дозу для ін'єкції).
Виробництво α-інтерферону з крові налагодила Фінляндія, а пізніше – Франція. З 1980 року в Японії розпочали виробництво інтерферонів за допомогою культури клітин лімфобластів. Синтез інтерферону індукували інфікуванням лімфобластів вірусом седней. Лімфобласти культивували у ферментерах. Інтерферон виділяли за допомогою афінної хроматографії з використанням моноклональних антитіл. У Швеції налагоджено виробництво лімфобластичного інтерферону у ферментерах об'ємом 200 л. В Англії був розроблений метод отримання β-інтерферону з фібробластів, виділених з тканин плода. Такі клітини можна підтримувати у культурі клітин, що відкриває можливість масового виробництва β-інтерферону.
Перераховані методи отримання інтерферонів з клітин людини характеризуються низьким виходом продукту, високою вартістю та недостатньою чистотою препарату. На сучасному етапі найбільш перспективним методом є біосинтез інтерферонів за допомогою генетично сконструйованих мікроорганізмів. Розробка генно-інженерної технології отримання інтерферонів була пов'язана з подоланням ряду труднощів. Шляхом зворотної транскрипції отримана кДНК інтерферону, незважаючи на те, що в суміші мРНК клітини доля мРНК інтерферону складає не більше 0,1%. Ген інтерферону був вбудований у векторну ДНК разом з бактеріальними регуляторними елементами, які забезпечують транскрипцію і трансляцію у бактеріальній клітині.
Виявилося, що в клітинах людини інтерферони синтезуються у вигляді попередників, які містять на N – кінці сигнальний пептид. В результаті специфічного протеолізу відбувається дозрівання попередника у зрілий інтерферон. У разі клонування гена інтерферону у Е. соlі бактеріальна клітина не містить ферментів, здатних відщепити сигнальний пептид і утворити зрілий інтерферон. У зв'язку з цим, щоб забезпечити синтез зрілого інтерферону у бактеріальній клітині, потрібно було від його гена відщепити фрагмент, що кодує сигнальний пептид, а потрібну частину використати для генно-інженерного конструювання рекомбінантної ДНК. Щоб розщепити ген інтерферону, була використана рестриктаза Sau 3A1, оскільки ген інтерферону містить три сайти розщеплення даною рестриктазою (один із сайтів розміщений поруч з сигнальною частиною). Неповний гідроліз гена цією рестриктазою дозволив виділити фрагмент гена, що кодує зрілий інтерферон, але без першого цистеїну. Триплет TGT, що кодує цистеїн, відщеплюється рестриктазою разом із сигнальним фрагментом. Для відновлення структури гена був синтезований хімічним шляхом невеликий фрагмент ДНК, який містив потрібний триплет, а також ініціюючий триплет ATG. Синтезований фрагмент ДНК був сполучений ДНК–лігазою з неповним геном інтерферону, отриманим за допомогою рестриктази Sau 3A1, і структура гена була повністю відновлена. Створений ген був з'єднаний з векторною ДНК таким чином, що він виявився розміщеним біля промотору, який забезпечив синтез мРНК інтерферону у трансформованих клітинах.
Синтезований генно-інженерним шляхом інтерферон був виділений, очищений і за своїми властивостями виявився подібним до отриманого з крові донорів. У теперішній час створено бактерії – продуценти, які синтезують до 5 мг інтерферону на 1л бактеріальної суспензії.
В різних лабораторіях отримані штами бактерій, які слугують продуцентами α-, β-, γ-інтерферонів. Слід підкреслити, що Е. соlі мало придатна для отримання β- та γ-інтерферонів, оскільки в бактеріальній клітині продукуються неглікозильовані білки. На сьогоднішній день гени інтерферонів клоновані у дріжджі та клітини вищих еукаріот.
Виробництво вакцин у значній мірі також будується на використанні генно-інженерних технологій. При цьому розрізняють рекомбінантні вакцини, що містять компоненти мікроорганізмів, отримані методами генної інженерії, та так звані ДНК-вакцини.
Прикладом створення рекомбінантних вакцин може слугувати отримання поверхневого антигену вірусу гепатиту В (HBsAg) за допомогою спеціально розробленої системи на основі дріжджів Pichia pastoris з використанням інтегруючого вектора. Спочатку ген HBsAg був вбудований між промотором гена алкогольоксидази 1 (АОХ1р) і сигналом термінації-поліаденілювання (AOX1t) того самого гена. Активність гена АОХ1 регулювали за допомогою метанолу. У його присутності на долю алкогольоксидази припадає до 30% всіх білків клітини, а за відсутності метанолу алкогольоксидаза не синтезується взагалі.
Вектор, спеціально сконструйований для цієї роботи, містив такі елементи: 1 – блок AOX1p-HBsAg-AOX1t; 2 – сайт ініціації реплікації, що функціонує у Pichia pastoris; 3 – фрагмент ДНК, що містить сайт ініціації реплікації плазміди pBR322 і селективний маркер Е.соlі; 4 – фрагмент Зґ-АОХ1, що сприяє інтеграції клонованої ДНК у певний сайт хромосоми; 5 – активний ген гістидинол-дегідрогенази (HIS4), який кодує фермент, що бере участь в синтезі гістидину. Наявність в цій конструкції послідовностей pBR322 дає змогу використовувати для роботи з нею Е.соlі, що полегшує клонування і за потреби сприяє отриманню великої кількості векторної ДНК.
Клон з інтегрованим фрагментом AOX1p-HBsAg-AOX1t при рості у присутності метанолу, що активує АОХ1-промотор, синтезував у великих кількостях аутентичний білок HBsAg, який накопичувався в цитоплазмі. Білковий продукт утворював такий же мультисубодиничний комплекс, як і відповідний білок у клітинах людини, інфікованих вірусом гепатиту В, і зв'язувався з антитілами цього вірусу. При вирощуванні даного клону у 240-літровому ферментері періодичної дії кількості синтезованого білка вистачало приблизно на 107 вакцинацій. При цьому генетична конструкція залишалася незмінною протягом 200 годин культивування у присутності метанолу.
Проводяться дослідження зі створення рекомбінантних пробіотиків як нового класу імунологічних препаратів. Серед лікувально-профілактичних препаратів, створених на основі живих мікроорганізмів, широко представлені пробіотики на основі представників нормальної мікрофлори, які продукують в організмі людини природні біологічно-активні молекули. Недоліком цих препаратів є відсутність у них вираженого імуномодулюючої та противірусної дії, тому до схеми лікування доводиться вводити цитокіни і, перш за все, інтерферон. Клонування гена інтерферону у клітини бактерій пробіотиків відкриває можливість створення нового класу препаратів для захисту і неспецифічної стимуляції імунітету слизових оболонок. Сконструйовані і досліджені рекомбінантні штами Bacillus, які продукують інтерферон, для включення у склад лікувально-профілактичних препаратів. Для комплексної активації імунітету необхідно додаткове введення антигену, що також можливо здійснити за допомогою рекомбінантних бактерій, сконструйованих на основі вакцинних штамів ентеробактерій (Кашперова и др. 2004).
Принцип застосування ДНК-вакцин полягає в тому, що в організм пацієнта вводять молекулу ДНК, яка містить гени імуногенних білків патогенного мікроорганізму. Для отримання ДНК-вакцин ген імуногенного білка мікроорганізму вбудовують у бактеріальну плазміду разом з генетичними елементами, потрібними для експресії цього гена в клітинах еукаріотів. Таку плазміду вводять у культуру бактеріальних клітин для отримання великої кількості копій. Потім плазмідну ДНК виділяють із бактерій, очищають від інших молекул ДНК і домішок. Очищена молекула ДНК і слугує ДНК-вакциною.
Введення ДНК-вакцини забезпечує синтез чужорідних білків клітинами вакцинованого організму, що сприяє виробленню імунітету проти відповідного збудника. При цьому плазміди, що містять відповідний ген, не вбудовуються у ДНК хромосоми людини. Вводять ДНК-вакцини внутрішньом'язово, використовуючи "генний пістолет" – пристрій, що приводиться в дію стиснутим гелієм. За допомогою цього пристрою безпосередньо у середину клітин "вистрілюють" мікроскопічні золоті гранули (близько 1-2 мкм), на яких фіксована ДНК.
Загалом генна інженерія дає змогу не тільки синтезувати білки, що становлять інтерес як такі, а і вводити в живу клітину особливі ферменти, регуляторні й будь-які інші білки. У такий спосіб можна надати клітині цілком нової ферментативної, регуляторної або транспортної активності, знайти яку серед нативних організмів або отримати випадковим мутагенезом було б досить маловірогідно.
Зброджування субстрату у виробництві етанолу здійснюють, в основному, за участю Saccharomyces cerevisiae, але замість нього часто використовують бактерію Zymomonas mobilis, так як ця паличка зброджує глюкозу, фруктозу і сахарозу з відносно великим виходом етанолу. У Z. mobilis також вища швидкість синтезу етанолу. До геному Z. mobilis були встроєні і експресовані деякі сторонні гени, відповідальні за розширення спектру субстратів, що утилізуються, зокрема, були введені гени глюкозо-ксилозоізомерази і ксилулокинази, необхідні для утилізації ксилози. До клітин Z. mobilis була введена плазміда, що несла два синтетичні оперони, один з яких кодував два ферменти розщеплення ксилози, а інший – два ферменти утилізації пентози (транскетолазу і трансальдолазу). Ці два синтетичні оперони були встроєні у човниковий вектор E.coli - Z. mobilis, яким і була трансформована бактерія Z. mobilis. Трансформовані клітини утилізували ксилозу і перетворювали пентози до фруктозо-6-фосфата і гліцеральдегід-3-фосфата, які потім перетворювалися на етанол. Трансформанти ефективно зростали на глюкозі, ксилозі і їх суміші і перетворювали ксилозу в етанол з великим виходом. Дана робота відкриває перспективи для використання при виробництві етанолу як джерела вуглецю ксилози, яка є побічним продуктом деревообробної та целюлозно-паперової промисловості.
Використовуючи технологію рекомбінантних ДНК можна спрямовано змінювати метаболізм мікроорганізмів, вводячи у них нові гени або модифікуючи вже існуючі. Головною метою таких змін є створення рекомбінантних мікроорганізмів з новою ферментативною активністю, здатних перетворювати існуючий субстрат на цінний продукт, звичайно отримуваний тільки поєднанням хімічних і мікробіологічних методів. Саме такий напрямок досліджень представляють біотехнології отримання цінних низькомолекулярних сполук. Прикладом може бути синтез за допомогою рекомбінантних мікроорганізмів L-аскорбінової кислоти (вітаміну С).
Нині для промислового виробництва L-аскорбінової кислоти використовують переважно трудомісткий процес, що охоплює одну мікробіологічну і кілька хімічних стадій. Вихідним субстратом для нього є D-глюкоза. На останньому етапі виробництва 2-кето-L-гулонова кислота (2-KLG) перетворюється у кислих умовах на L-аскорбінову кислоту. Біохімічні дослідження метаболізму різних бактерій показали, що 2-KLG не синтезується прямо з глюкози. Так, одні бактерії (Acetobacter, Gluconobacter та Erwinia) можуть перетворювати глюкозу на 2,5-дикето-D-глюконову кислоту (2,5-DKG), а інші (Corynebacterium, Brevibacterium та Arthrobacter), які синтезують фермент 2,5-DКG-редуктазу, – перетворювати 2,5-DKG на 2-KLG.
З метою поєднання всіх стадій утворення 2-KLG у метаболізмі одного рекомбінантного мікроорганізму було виділено ген 2,5-DKG-редуктази Corynebacterium sp. і перенесено в Erwinia herbicola. Першими етапами на цьому шляху були виділення і очищення 2,5-DKG-редуктази Corynebacterium sp. і визначення послідовності її перших 40 N-амінокислот. Виходячи з цих даних були синтезовані два 43-нуклеотидні гібридизаційні зонди, які відповідали різним частинам білкової молекули. Синтезовані зонди використовували далі для скринінгу банку клонів ДНК Corynebacterium. У такий спосіб виділили клон, що містив ген 2,5-DKG-peдyктази, і далі секвенували цей ген. Нуклеотидні послідовності, розміщені до стартового кодону ATG, вирізали і замінювали їх на сигнали транскрипції та трансляції, що функціонують у Е.соlі, оскільки регуляторні послідовності грампозитивних мікроорганізмів типу Corynebacterium не функціонують у клітинах кишкової палички. Отриману конструкцію далі вводили у Е.соlі (при цьому синтезувалася активна 2,5-DKG-peдyктаза), а потім переклоновували у векторі з широким колом хазяїв і трансформували їм Erwinia herbicola.
Трансформовані клітини Erwinia активно перетворювали D-глюкозу безпосередньо на 2,5-KLG, при цьому власні ферменти Erwinia, локалізовані у внутрішній мембрані бактерійної клітини, активно перетворювали глюкозу на 2,5-DKG, а 2,5-DKG-редуктаза, локалізована в цитоплазмі, каталізувала подальше перетворення 2,5-DKG на 2,5-KLG. Отже, за допомогою генно-інженерних маніпуляцій метаболічні реакції, що проходять у таких різних мікроорганізмах, вдалося здійснити в одному з них.
Ще один приклад застосування рекомбінантних мікроорганізмів для отримання цінних низькомолекулярних сполук – отримання з їх допомогою барвника індиго. Відомо, що багато бактерій, особливо роду Pseudomonas, здатні утилізувати різні органічні сполуки типу нафталіну, толуолу, ксилолу і фенолу, які є для них єдиним джерелом вуглецю. Дуже часто гени ферментів, що каталізують розщеплення цих органічних сполук, розміщуються у великих природних плазмідах (завдовжки 20–50 тис.п.н). При дослідженні одного з трансформантів, отриманих введенням до клітин Е.соlі однієї з таких плазмід (яка до того ж містила вставку довжиною 10,5 тис.п.н.), здатного внаслідок цього перетворювати нафталін на саліцилову кислоту, виявилося, що мінімальне ростове середовище, яке містить триптофан, набуває синього забарвлення. Аналіз показав, що трансформовані клітини Е.соlі синтезували барвник індиго.
Індиго – синій пігмент, застосовуваний для фарбування вовни і бавовни, був вперше виділений з рослин. Нині його отримують хімічним синтезом. Цим барвником фарбують джинсову тканину, і тому попит на нього більший, ніж на будь-який інший барвник. Можливість одержання індиго за допомогою мікроорганізмів дає змогу розробити досить ефективний і ощадний крупномасштабний мікробіологічний спосіб його виробництва, що виключає використання токсичних речовин, до яких вдаються при хімічному синтезі індиго.
Важливість антибіотиків для людства загальновідома. Кожного року в світі відкривають до 200 нових антибіотиків, проте користуються тільки тими, які мають велику терапевтичну цінність і становлять економічний інтерес. На їх частку припадає лише 1-2 % усіх антибіотиків. Великий ефект в цій галузі дає технологія рекомбінантних ДНК. По-перше, з її допомогою можна створювати нові антибіотики з унікальною структурою, які потужніше діють на певні мікроорганізми і мають мінімальні побічні ефекти. По-друге, генно-інженерні підходи можуть бути використані для зниження вартості їх виробництва.
Процес біосинтезу одного антибіотика може складатися з 10-30 ферментативних реакцій, тому клонування всіх генів його біосинтезу є досить складним завданням. Один з підходів до виділення повного набору таких генів ґрунтується на трансформації одного або кількох мутантних штамів, не здатних синтезувати даний антибіотик, банком клонів, створених з хромосомної ДНК штаму дикого типу. Після введення банку клонів у мутантні клітини відбирають трансформанти, здатні синтезувати антибіотик. Потім виділяють плазмідну ДНК клону, що містить функціональний експресуючий ген антибіотика, і використовують її як зонд для скринінгу іншого банку клонів хромосомної ДНК. З цього банку відбирають клони, що містять нуклеотидні послідовності, які перекриваються з послідовностями зонду. Таким чином ідентифікують, а потім клонують елементи ДНК, що межують з комплементарною послідовністю, і відтворюють повний набір генів біосинтезу антибіотика.
Цей підхід з успіхом застосовувався для ідентифікації деяких генів біосинтезу ундецилпродігіозану з Streptomyces coelicolor A3. В цьому разі використовували комплементаційний аналіз, що ґрунтується на порівнянні кольору колоній: колонії мікроорганізмів дикого типу – червоного кольору, а колонії мутантних мікроорганізмів – кремового.
Працюючи з генами, що беруть участь у біосинтезі вже відомих антибіотиків, отримують нові антибіотики з унікальними властивостями і специфічністю. За допомогою генної інженерії можна не тільки створювати нові антибіотики, а і збільшувати ефективність синтезу вже відомих. Лімітуючим фактором у промисловому виробництві антибіотиків за допомогою Streptomyces іноді виступає кількість доступного клітинам кисню. Внаслідок поганої розчинності кисню у воді та високої щільності культури Streptomyces його часто виявляється замало, ріст клітин уповільнюється і вихід антибіотика знижується. Для вирішення цієї проблеми створюють рекомбінантні штами Streptomyces, які ефективніше використовують наявний кисень.
Одна із стратегій, використовуваних деякими аеробними мікроорганізмами для виживання в умовах нестачі кисню, полягає в синтезі гемоглобіноподібного продукту, здатного акумулювати кисень і доставляти його у клітини. Наприклад, аеробна бактерія Vitreoscilla sp. синтезує гомодимерний гемвмісний білок, функціонально подібний до еукаріотичного гемоглобіну. Ген такого "гемоглобіну" з Vitreoscilla був виділений, вбудований у плазмідний вектор Streptomyces і введений у клітини цього мікроорганізму. При цьому трансформовані клітини S. coelicolor, що росли при низькому вмісті розчиненого кисню (приблизно 5 % від насичувальної концентрації), синтезували у 10 разів більше антибіотика актинородину на 1 г сухої клітинної маси і мали більшу швидкість росту, ніж нетрансформовані. Цей підхід використовують і для забезпечення киснем інших мікроорганізмів, що ростуть в умовах нестачі кисню.
Деякі з високомолекулярних сполук, синтезованих живими організмами, - біополімерів - мають цінні фізичні та хімічні властивості, внаслідок чого їх використовують у харчовій, переробній та фармацевтичній промисловості. З виникненням технології рекомбінантних ДНК з'явилася можливість створення нових біополімерів, заміни синтетичних продуктів на їх біологічні аналоги, модифікування вже існуючих біополімерів з метою покращання їх фізичних та структурних характеристик, підвищення ефективності відповідних промислових процесів, зменшення їх вартості.
Одним з прикладів генно-інженерної розробки у цьому напрямі є створення рекомбінантної бактерії Xantomonas campestris з метою отримання ксантанового слизу. Цінний комерційний біополімер – ксантановий слиз є високомолекулярним екзополісахаридом. Він має високу в'язкість, не руйнується у агресивних фізичних та хімічних середовищах й за фізичними і хімічними властивостями нагадує пластик. Зокрема його використовують як стабілізуючий, загущуючий або суспендуючий агент. Для успішного комерційного виробництва ксантанового слизу треба вирощувати X. campestris на недорогому і доступному джерелі вуглецю. X. campestris дикого типу ефективно утилізує глюкозу, сахарозу і крохмаль, але не лактозу. З іншого боку, у промисловому виробництві сиру утворюється такий побічний продукт, як сироватка, що складається з води (94-95 %), лактози (3-4 %), і невеликих кількостей білка, мінеральних речовин і низькомолекулярних органічних сполук. Молочна промисловість дає величезні кількості сироватки, її утилізація – це велика проблема.
Сироватку можна використовувати як джерело вуглецю при вирощуванні цінних промислових мікроорганізмів. Щоб Х. campestris набув здатності рости на сироватці, був застосований такий прийом. Гени lacZY E.coli, що кодують ферменти β-галактозидазу та лактозопермеазу, вбудували у плазміду з широким колом хазяїв таким чином, щоб вони перебували під транскрипційним контролем промотору одного з бактеріофагів X. campestris. Цю конструкцію ввели у E.coli, а потім перенесли з E.coli до X. campestris потрійним схрещуванням. Отримані у такий спосіб трансформанти, що містили плазміду, синтезували β-галактозидазу та лактозопермеазу, використовуючи лактозу як єдине джерело вуглецю, а також продукували у великих кількостях ксантановий слиз, використовуючи як джерело вуглецю глюкозу, лактозу і сироватку.
Ще один приклад – отримання меланіну. Меланіни – це численна родина різних біополімерів, що поглинають світло. Їх синтезують тварини, рослини, бактерії та гриби. Ці пігменти використовують у виготовленні сонцезахисних екранів і покриттів, а також як добавки до косметичних засобів. Нині меланіни отримують у невеликих кількостях переважно екстракцією з природних джерел або хімічним синтезом. Одночасно на основі технологій рекомбінантних ДНК розвивається недороге крупномасштабне виробництво меланінів з різними фізичними властивостями.
Меланіни – це нерегулярні полімери, що складаються із залишків індолу, бензотіазолу та амінокислот. Перший етап їх біосинтезу каталізується купрумвмісним ферментом монооксигеназою тирозинази і являє собою окиснення тирозину до дигідроксифенілаланінхінону. Останні етапи полімеризації не є каталітичними реакціями і залежно від хімічної природи нехінонних сполук, що включаються в полімерну структуру, дають кінцеві продукти різних кольорів: чорного, коричневого, жовтого, червоного або фіолетового.
Були виділені й охарактеризовані гени біосинтезу меланіну в клітинах Streptomyces antibioticus. Один з них кодує тирозиназу, а другий (ORF438) – білок з невідомими функціями. Ці гени спочатку переклонували у експресуючий вектор E.coli, при цьому одна конструкція містила тільки ген тирозинази, а друга – і ген тирозинази, і ORF438. Виявилося, що для біосинтезу меланіну потрібні продукти обох генів.
За допомогою генетичної інженерії робляться спроби здійснити мікробіологічний синтез каучуку. Натуральний каучук, цис-1,4-поліізопрен, – це широко використовуваний біополімер, який отримують з різних рослин. Його біосинтез починається з перетворення простих цукрів і охоплює 17 ферментативних реакцій. Передусім за допомогою мРНК з рослини Hevea brasiliensis, що синтезує каучук, створили відповідну кДНК бібліотеку. Потім провели гібридизацію з коротким ДНК-зондом, синтезованим виходячи з даних щодо амінокислотної послідовності однієї з ділянок молекули полімерази каучуку. Для того щоб довести, що клонована кДНК дійсно кодує цей фермент, застосували антитіла до очищеного ферменту. Тепер дослідники, використовуючи цей клон кДНК, намагаються синтезувати натуральний каучук мікробіологічними методами. Робота в цьому напрямі триває, і у перспективі буде створено нову технологію біосинтезу каучуку.
ДОСЯГНЕННЯ ТА ПЕРСПЕКТИВИ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ РОСЛИН
Рослини є основними первинними продуцентами біомаси на нашій планеті. Саме вони здатні за використання неорганічних компонентів та енергії сонячного світла створювати в процесі фотосинтезу органічну речовину, яка є основою для життя представників інших царин живих істот.
Людство з давніх часів використовувало дикоростучі рослини для їжі, лікування, на корм тваринам, для отримання тепла та побудови житла, інших господарчих потреб. В період раннього неоліту, приблизно 8 тис. років до н. е. прадавні люди перейшли від збирання дикоростучих рослин до їх цілеспрямованого вирощування. Окультурювання дикоростучих рослин разом з доместикацією диких тварин дозволило побороти продовольчу кризу, що сталася внаслідок збільшення чисельності людей, різкої зміни клімату та винищення крупних диких тварин. У теперішніх час людство використовує для своїх потреб безліч видів рослин, з яких більше 1500 видів складають культурні (культивовані) рослини.
Культурною рослиною є рослина, яка цілеспрямовано висівається або висаджується у відкритий чи закритий (тепличний) ґрунт, вирощується та з якої збирається врожай. Врожаєм можуть бути окремі частини рослини - насіння, плоди, листки, пагони, стебла, паростки, корені, бруньки, квітки, суцвіття тощо, або цілі рослини, які після збору використовують для різних потреб. Інколи рослини висаджуються і вирощуються, але не задля збору врожаю, а заради освоєння та використання тих чи інших територій шляхом озеленення, лісорозведення, рекультивації, ремедіації, відновлення рідких та зникаючих видів та екосистем, підтримання колекцій тощо. Останнім часом з’являються та поширюються технології крупномасштабного вирощування ізольованих від рослини клітин, тканин та органів на штучних живильних середовищах in vitro, які дозволяють спрямовано отримувати певний цільовий продукт.
За напрямками використання рослини поділяються на:
харчові – використовуються в харчуванні людини,
кормові – використовуються в харчуванні тварин,
лікарські – використовуються в медицині, косметиці, ветеринарії,
декоративні – використовуються для озеленення, оздоблення,
технічні – використовуються для виробничих потреб як сировина, допоміжні матеріали, засоби виробництва та у господарській діяльності. До останніх відносяться і рослини, які застосовуються для покращення екологічного стану довкілля, порушених техногенних територій, земель та водойм сільськогосподарського призначення. Останнім часом серед технічних культур стали виділяти біоенергетичні культури, біомаса яких використовується для отримання відновлюваних джерел енергії. Інколи рослини вирощується для використання в культах і обрядах, як модельні в наукових дослідженнях.
Один і той же вид рослин може використовуватися за різним призначенням.
Вирощуючи той чи інший вид рослини людина з давніх давен намагалася поліпшити саму рослину і підібрати умови, які б забезпечили її найкраще культивування та отримання врожаю необхідної кількості та якості. Відповідно виникли дві сфери діяльності людини – селекція рослин та рослинництво, які у наш час є науковими напрямками підвищення ефективності сільського та лісового господарства, біотехнологічних виробництв.
Генетичне, спадкове поліпшення рослин, яке відбувається через селекцію, призвело до виникнення їх значної внутрішньовидової різноманітності. Для основної маси культурних рослин в рамках виду існує величезна кількість різновидів, сортів, ліній, гібридів, популяцій, калтиварів тощо. Селекція рослин має два основні етапи: створення генетичного різноманіття та відбір серед цього різноманіття найкращих варіантів. Генетичне різноманіття в традиційному селекційному процесі створюється за рахунок рекомбінаційної та мутаційної мінливості, спонтанної чи індукованої. Як відомо, рекомбінаційна мінливість не веде до утворення нових варіантів генів, а забезпечує виникнення лише нових поєднань генів у хромосомах, хромосом в гаметах і соматичних клітинах та гамет в зиготах. Власне мутаційна мінливість веде до утворення нових варіантів генів, але в традиційному розумінні мутаційна мінливість завжди є нецілеспрямованою. За дії мутагенних факторів виникає широкий спектр мутаційних змін, серед яких є користі, нейтральні та шкідливі, причому корисні з’являються з дуже низькою частотою внаслідок дії стабілізуючої форми природного добору. Потрібні чималі зусилля та час на пошук, виділення і закріплення корисних мутагенних змін у рослин.
Генетична інженерія рослин являє собою унікальну можливість цілеспрямованого збільшення генетичного різноманіття, коли до геному рослини вноситься конкретний ген або гени, спрямовано змінюється її геном для поліпшення тієї чи іншої функції. Таким чином, генетична інженерія забезпечує спадкове удосконалення рослини і завжди має практичний вихід у селекцію. Генетично-інженерні дослідження закінчуються створенням нового сорту, штаму, лінії, гібриду тощо, які мають бути зареєстровані як інтелектуальна власність.
Генно-інженерне удосконалення рослин відбувається за напрямками, за якими проводиться селекція тієї чи іншої культурної рослини. Основними напрямками генетичної інженерії рослин є збільшення продуктивності, покращення якості врожаю та продуктів, які з нього виробляються, підвищення стійкості рослин до абіотичних та біотичних факторів, адаптація до промислових технологій виробництва цільових продуктів та інші. Означені напрямки у теперішній час мають різний ступінь розробленості.
Першою трансгенною харчовою рослиною, дозволеною до комерційного використання у 1994 році, став сорт томатів Flavr Stavr, створений фірмою Calgene (США). Ці томати вирощуються влітку і за рахунок зміну терміну дозрівання можуть довго зберігатися, досягаючи зрілості лише взимку.
В генетичній інженерії рослин як виключно селективні, маркерні та репортерні успішно використовуються гени ß-глюкуронідази, ß-лактамази, фосфоманозоізомерази і неоміцинфосфотрансферази кишкової палички, ген люциферази світляка, гени зеленого флуоресцентного білка медузи, червоного флуоресцентного білка Discosoma та інші.
Першими практичними генно-інженерними розробками були сорти рослин зі стійкістю до гербіцидів та комах, оскільки ці ознаки є моногенними, і легко прослідковуються як у системі in vitro, так і in vivo. Полігенні ознаки, такі як врожайність, продуктивність, системна стійкість до хвороб, модифікація складних метаболічних шляхів для збільшення чи зменшення синтезу певного метаболіту для генно-інженерного поліпшення потребують спеціальних підходів і чималих зусиль, відтак у теперішній час знаходяться у стані інтенсивної розробки.
Стійкість до абіотичних факторів. Основними абіотичними факторами, від яких страждають культурні рослини, є посуха, спека, приморозки, холод, гербіциди. Створення стійкості до цих агентів можливо із застосуванням генетично-інженерних підходів. Особливо актуальними створення стійкості до абіотичних факторів у рослин із залученням генів сторонніх організмів стає у разі відсутності механізмів природної стійкості.
Гербіциди – це хімічні речовини, які використовуються для боротьби з бур’янами у посівах та насадженнях сільськогосподарських та інших рослин. Нажаль гербіциди здатні пригнічувати ріст не тільки бур’янів, але і самої культурної рослини. Гербіциди різняться за механізмом дії на рослину. Найчастіше токсична дія гербіциду обумовлена пригніченням активності того чи іншого ферменту. У разі відсутності у культурної рослини системної стійкості до певного гербіциду необхідно визначити біохімічні мішені його дії, знайти ген стійкості до гербіциду у інших організмів, клонувати його та ввести до геному культурної рослини.
Basta – контактний гербіцид широкого спектру дії. Його діюча речовина, глюфосинат амонію, представляє собою еквімолярну, рацемічну суміш D- та L-ізомерів фосфінотрицину. Активною складовою глюфосинату амонію є L-ізомер фосфінотрицину - структурний аналог глутамату (рис. 1).
В рослинах дія фосфінотрицину спрямована на діяльність ферменту глутамінсинтетази. Глутамінсинтетаза у присутності АТФ каталізує утворення амінокислоти глутаміну з глутамату і аміаку і, таким чином, приймає участь в знешкодженні аміаку у тканинах. Фосфінотрицин як структурний аналог глутамату блокує роботу глутаминсинтетази шляхом конкурентного інгібування.


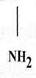
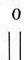
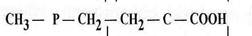
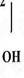


Фосфінотрицин Глутамат
Рис. 1. Структурні формули фосфінотрицину та глутамату.
За інгібування глутамінсинтетази загибель клітин (наприклад, у бур’янних та інших рослин) настає через токсичне накопичення аміаку. Ген bar Streptomyces hygroscopicus кодує фермент фосфінотрицинацетилтрансферазу (РАТ), яка ацетилює фосфінотрицин, роблячи його неактивним по відношенню до глутамінсинтетази рослинних клітин. Отримано генетично-модифіковані рослини кукурудзи, які через цей механізм стають стійкими до фосфінотрицину (гербіциду Basta).
Ще одним геном стійкості до гербіцидів є мутантний ген ацетолактатсинтетази (ALS), знайдений у тютюну і арабідопсису, який забезпечує стійкість до хлорсульфурону. Хлорсульфурон в рослинах інгібує ацетолактатсинтетазу, перешкоджаючи синтезу амінокислот з розгалуженим ланцюгом – лейцину, ізолейцину та валіну. Стійкість до даного гербіциду створюється за рахунок введення в геном рослини мутантної форми гена ацетолактатсинтетази, ферментативно функціональної, але значно менш чутливої до інгібування хлорсульфуроном порівняно з нормальним ферментом. Отримано рослини кукурудзи, стійкі до хлорсульфурону.
Гліфосат (N-(фосфонометил)гліцин) є активною речовиною гербіциду раундапу («Roundup Ready», «RR»). Гліфосат інгібує в рослинах активність 5-єноїлпірувоїл-шикимат-3-фосфатсинтетази (EPSPS). Цей фермент синтезує хоризмат, який є попередником синтезу ароматичних амінокислот – фенілаланіну, тирозину та триптофану, а також саліцилової кислоти, деяких алкалоїдів. Оброблені гліфосатом рослини не можуть синтезувати ароматичні амінокислоти та інші ароматичні сполуки і тому гинуть. У певних штамів Salmonella, Agrobacterium, Escherichia присутні мутантні гени aro A, які забезпечують стійкість до гліфосату. Введення в геном кукурудзи мутантної форми гена aro A з геному Salmonella typhimurium, яка кодує слабкочутливий до гліфосату фермент єнолпірувілшикиматфосфатсинтетазу, привело до отримання рослин, стійких до гліфосату. Для створення стійкості до гліфосату використаний також ген єнолпірувілшикиматсинтетази стійкої до гліфосату ґрунтової бактерії Agrobacterium tumefaciens, штаму СР4. У теперішній час фірмами Syngenta, Monsanto, Pioneer, Pioneer and Dow Agro Sciences офіційно зареєстровані стійкі до гліфосату лінії і гібриди кукурудзи. Ген EPSPS перенесено також до клітин сої, але до нього було додано сигнальний пептид СТР4 від Petunia hybridа, який полегшує доставку новосинтезованого ферменту до хлоропластів, де відбуваються метаболічні реакції шикиматного шляху і де розташовані ділянки, на які впливає гліфосат. Після доставки ферменту до хлоропластів сигнальний пептид видаляється специфічною протеазою. Близько 60% усієї сої у світі представлено трансгенними сортами. США вирощують 90%, Аргентина 98%, Уругвай 100% генетично-модифікованої сої. Практично вся генетично-модифікована соя містить ген стійкості до гліфосату (RR-соя). RR-сою можна обробляти раундапом від проростання до квітування без зниження темпів росту, що є ефективною і маловитратною технологією боротьби з бур’янами в її посівах. Генетично-модифікована соя дозволена до імпорту та харчування у більшості країн світу, тоді як вирощування трансгенної сої дозволено не в усіх країнах, оскільки існує можливість виникнення бур’янів, стійких до гліфосату.
Гербіцид дикамба (3, 6 – дихлор – 2 – метоксибензойна кислота) представляє собою синтетичний ауксин, якому властива інгібуюча дія. Дикамба в меристематичних тканинах порушує обмін нуклеїнових кислот, синтез білків та інші фізіологічні функції рослин. Вона вибірково знешкоджує дводольні рослини і майже не впливає на однодольні. З цієї причини її поширено використовують в посівах кукурудзи та інших злакових культур. Дикамба зберігається в ґрунті до кількох місяців і практично не потрапляє у ґрунтові води. Хімічна структура дикамби стабільна, але вона швидко знешкоджується ґрунтовими мікроорганізмами. Недоліком дикамби є висока летючість, яка виключає використання цього гербіциду безпосередньо біля виноградників і садів. У бактерії Pseudomonas maltophilia ізольований ген, який забезпечує стійкість до гербіциду дикамба. Цей ген перенесено до арабідопсису, тютюну, сої, томатів, кукурудзи та інших злаків, створено сорти, стійкі до цього гербіциду.
Створення рослин, стійких до посухи, спеки, холоду є значно складнішим завданням, ніж до гербіцидів, оскільки ці ознаки є полігенними.
Рослини, стійкі до холоду, посухи та засолонення, отримані у Nicotina tabacum, Triticum aestivum та Zea mays за рахунок суперекспресії гена транскрипційного фактора CBF3 арабідопсису під контролем індуцибельного промотору. Посухостійкість у кукурудзи отримана в експериментах із введенням в геном цієї рослини гену НАДФ-залежної глутаматдерідрогенази кишкової палички. Підвищену холодостійкість рослини кукурудзи також виявляли при модифікації геном bet A кишкової палички, який кодує холіндегидрогеназу.
Стійкість до біотичних факторів. Культурні рослини страждають від різних типів біоти, що призводить до зниження врожайності, вилягання, в’янення, усихання і може закінчитися повною загибеллю рослини. Пошкодження рослин спричиняється шкідниками – комахами, нематодами, гризунами тощо. Хвороби рослин викликають грибні, бактеріальні та вірусні патогени.
У рослин існує певна природна стійкість до пошкоджуючих біотичних факторів, яка ґрунтується на генетично обумовлених анатомічних, морфобіологічних, фізіологічних, біохімічних особливостях. Але в сучасних умовах інтенсивного агропромислового виробництва, за впровадження монокультур з’являються і швидко розповсюджуються нові види шкідників і хвороб, до яких у рослин немає природного імунітету. Важливу роль в боротьбі з біологічним пошкодженням рослин відіграють технологічні заходи, зокрема, використання хімічних засобів боротьби – інсектицидів, але останні є екологічно небезпечними при виробництві івикористанні та здатні накопичуватися в ґрунті, воді, живих істотах. Більш ефективним і екологічно безпечним є підвищення генетичного потенціалу стійкості шляхом селекції, в якій широко використовуються досягнення генетичної інженерії.
Стійкість до комах. Важливим здобутком генетичної інженерії рослин, який має практичне значення, є вбудовування в геном рослин Bt- генів, які здатні надати рослинам стійкість до комах. Ці гени кодують інсектицидні білки і виділені з геному бактерії Bacillus thuringiensis (тюрингська бацила). Інсектицидні білки Bacillus thuringiensis відносяться до дельтаендотоксинів (δ-токсини) та позначаються як CRY-білки, оскільки виробляються бактерією як параспоральні тільця кристалічної (crystal) форми. Різні штами Bacillus thuringiensis продукують різні форми CRY-білків, які забезпечують високоспецифічний ентомоцидний ефект по відношенню до різних груп комах. Зокрема, на стадії личинки для лускокрилих (Lepidoptera) токсичними є CRY-білки класів CRY1, CRY2 і CRY9, для твердокрилих (Coleoptera) - класу CRY3, для двокрилих (Diptera) - класів CRY2, CRY4 і CRY11. CRY-білки є протоксинами. У кишківнику комахи протоксин під дією ферментів кишківникового соку переходить у токсин. Далі токсин зв’язується з рецепторами епітеліальних клітин кишківника, що призводить до конфірмаційних змін в молекулі токсину. Після цього альфа-спіралі N- кінцевого домену токсину утворюють в клітинній мембрані іонні канали, що призводить до загибелі клітин. Зв’язування токсину з рецепторами кишківника є високоспецифічним.
Модифіковані спеціально для експресії в рослинах Bt- гени використовують для контролю за лускокрилими та твердокрилими шкідниками у томату (стійкість до декількох видів шкідників), картоплі (стійкість до колорадського жука), тютюну (стійкість до тютюнового бражника), бавовника (стійкість до тютюнової совки) та інших культур. У кукурудзи гени Bt застосовуються для створення стійкості до європейського кукурудзяного метелика. Існують відомості про активність специфічних білків B. thuringiensis проти лучного метелика, кукурудзяної молі та совки. Для достатньої експресії у клітинах еукаріотів прокаріотичні гени Bt повинні бути модифіковані. Зокрема, для генетичної трансформації кукурудзи методом біолістики були використані копії гена cryIA(b), які містили модифіковану кодуючу послідовність, під контролем сильного конститутивного промотора CaMV 35S, з використанням лідерної послідовності інтрона гена білка теплового шоку HSP70 кукурудзи. В зареєстрованих генотипах кукурудзи присутні інтродуковані гени сry1A.105, сry2Ab2, cry1F. У 2007 році трансгенна кукурудза, стійка до кукурудзяного метелика за рахунок присутності в геномі Bt -генів, вже вирощувалася в Європейському Союзі на 110 тис. га. На сьогодні Bt -рослини займають основну частку у загальному обсязі виробництва генетично модифікованої кукурудзи та бавовника.
Серед твердокрилих шкідників дуже небезпечним є західний кукурудзяний ко
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3716; Нарушение авторских прав?; Мы поможем в написании вашей работы!