
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Превращение окисла в новое химическое соединение, например силикат
1→2FeO+SiO2 = Fe2 SiO4
сопровождается дополнительной убылью ΔG°1, что следует учесть в выражении кислородного потенциала конденсированной фазы
pО (МеО) + ΔG .
.
В результате понижается pО(МеО), а затруднения в восстановительном процессе
2→ 0,5 Fe2 SiO4+СО= Fe+ SiO2+СО2.
проявляются в смещении равновесие в сторону большого содержания СО. А.С. Тумарев экспериментально показал, что химические соединения, например феррит магния, ведут себя как новые самостоятельные вещества со своими ступенями восстановления, отличающимися оттого, что дают окислы, из которых они получаются. Б.Г. Лебедев изучал восстановимость и термодинамическую устойчивость ортосиликатов металлов железной триады. Равновесные газовые смеси, образующиеся при взаимодействии с Ni2 SiO4, Co2 SiO4 и Fe2 SiO4 характеризуется повышенном содержанием восстановителя СО по сравнению с реакциями для чистых окислов NiО, СоО, FeО. Установлено, что восстановимость силикатов ухудшается в направлении увеличения ионного радиуса катиона (Ni®CO®Fe®Ca). При этом кальциевый силикат Са2 SiO4 оказывается более прочным соединением при наличие в системе извести следует учитывать возможность обменной реакции
3→Fe2 SiO4+2СаО=2 FeО+ Са2 SiO4
Эта реакция по сравнению с реакцией связывания окисла в силикат (3) развивается с противоположном направлении и убыль ΔG°2 следует учитывать с противоположном знаком. В результате возрастает первый член соотношения (1)
ΔG°МеО + ΔG°1– ΔG°2,
а повышение кислородного потенциала окисла pО(МеО) облегчает восстановления металла и смещает состав равновесной газовой фазы к меньшим содержанием СО. Аналогичное влияние оказывает дополнительное образование химических соединении при участии реагирующего металла, например силицида железа FeSi или карбида марганца Mn3C. В этом случае прочность окисла, оцениваемая величиной ΔG°(МеО) реакции
2Fe+ O2=2 FeО
изменяется под влиянием реагирования металла
2Fe+2Si=2 FeSi
на величину убыли ΔG°3 образования силицида (или карбида). Последняя величина, принятая с обратном знаком как для исходного вещества, в совокупности
ΔG°МеО -ΔG°3
Повышает кислородный потенциал реагирующего окисла и, согласно уравнению (1,24), полноту использование восстановителя. Таким образом, карбидообразования при восстановлении окислов смещает состав газовой фазы в сторону меньших содержаний СО и понижает температуру начала восстановления при участие твердого углерода. В реальных сложных системах основную часть металлической фазы составляет железо, которое служит растворителем для других металлических и неметаллических компонентов. Наряду с этим реагирующие окислы образует свой раствор, называемый обычно шлаком или шлаковой фазой.
При изучении свойства и свойств газовой фазы установлено, что атмосферы, содержащие СО-СО2, не только проявляют окислительно-восстановительную способность, но и обладают определенном потенциалом углерода pс Следствием общей термодинамической тенденции к его выравниванию является переход углерода из газовой фазы к металлу и науглероживание последнего. Это звено оказывается неизбежным дополнением к восстановительному процессу, развивающемуся в атмосфере углеродосодержащих газов.
В технике широко распространение получил процесс поверхностного науглероживания сплавов железа – их цементация при помощи газообразных, жидких и твердых карбюризаторов. После дополнительной термической обработки обеспечивается повышение поверхностной твердости при достаточной вязкости в объеме.
 Общие закономерности науглероживания или цементации железо хорошо выявляется на примере его взаимодействие с окисью углерода. При этом возможно образования раствора углерода в металле:
Общие закономерности науглероживания или цементации железо хорошо выявляется на примере его взаимодействие с окисью углерода. При этом возможно образования раствора углерода в металле:
2СО=[C]Fe+ СО2. – ΔH;
или предельное науглероживание с образованием метастабильного карбида железа Fe3C, но достаточно устойчивого при повышенных температурах:
3 Fe+2СО= Fe3C+ СО2. – ΔH
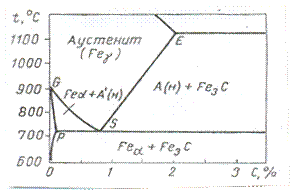
Рис.6. диаграмма состояния системы Fe-C.
Имеются данные о существования других форм карбидов; в частности, известны кристаллические модификации Fe2C, обнаруживаемые ниже 200-400°С. Реакции цементации железа имеют сходство с реакцией газификацией углерода. Это отражается на термодинамических величинах ΔH и ΔG° реакции.
Принцип смещения равновесия выявляет качественные зависимости полноты науглероживания металла. Ему содействует возможные понижение температуры и увеличение давления газовой фазы. Однако более полную картину функциональной связи переменных, определяющих конечное, равновесное состояние, дает правило фаз. Предварительно необходимо установить природу углеродсодержащих твердых фаз. Природа и число совместно сосуществующих фаз железа выявляется из диаграммы состояния Fe – С. К процессам цементации относится часть диаграммы метастабильной системы области О – 2% и 500-1200°С (7 рис.) Равновесные линии ограничивают области гетерогенности и области гомогенных растворов углерода в железе. До точки S феррит Feα сосуществует с аустенитом, насыщенным железом А¢н или с цементитом Fe3C. За этой точкой цементит оказывается в равновесии с аустенитом, насыщенным углеродом Ан, или с ферритом.
Таким образом, выявляются возможные комбинации различных твердых фаз, реагирующих с СО-СО2, в зависимости от температуры и общего содержания углерода. Им соответствует различные варианты реакции и равновесии со своими характерными признаками. (таб.1)
| № | Взаимодействие фаз | Значения величин | Признаки равновесия при Р=пост. | ||
| К | Ф | С | |||
| А=СО- СО2 А¢н+Feα = СО- СО2 Fe3C+ Feα = СО- СО2 Ан+ Fe3C= СО- СО2 | РСО/РСО2=¦(Т,Nc); РСО/РСО2=¦(Т); РСО/РСО2=ψ(Т); РСО/РСО2=F(Т); |
Таблица 1 - Возможные реакции цементации железа и термодинамические их признаки
Для описания равновесных состояний системы требуются переменные Р и Т, а также характеристики состава конденсированной (Nc) и газообразной (РСО/РСО2) фаз. Компонентами системы являются Fe, С и СО2; в зависимости от числа реагирующих фаз получаем число степеней свободы:
С = К+2–Ф.
Для вариантов возможных равновесии 2, 3 и 4 (см.таб.1), когда присутствуют две конденсированные фазы.
С = 2;
РСО/РСО2 =¦(Т,Р);
При постоянном давлении состав газовой фазы определяется только температурой.
Другие функциональные связи получаем два варианта 1, предусматривающего реагирования однородного раствора углерода в аустените:
С = 3;
РСО/РСО2= φ(Т,Р, Nc);
При постоянном давлении каждому заданному содержанию углерода в аустените должна отвечать своя температурная функция состава газовой фазы. Выявленные таким образом зависимости можно выразить в количественной форме при помощи константы и ее температурной функции.
Для описанных реакции (52),(53) и возможных вариантов реагирования справедливо одно и о то же выражение константы равновесия, ранее представленное для реакции газификации углерода:
Кр¢1= Кр¢2= Кр¢3= Кр¢4= Р²СО/ РСО2 ·аС=Кр
lnКр=-(9001/Т)+9,28
Изменения происходят в самом выражении константы в зависимости от активности углерода в реагирующей твердой фазе. Увеличение активности углерода должно сопровождаться возрастанием СО в равновесной фазе. На этом основании можно сравнить состояния углерода в графите и в метастабильном карбиде Fe3C. Из равенства (54) получаем:
1/аС(Р²СО/ РСО2)С=1/а Fe3C(Р²СО/ РСО2) Fe3C;
а Fe3C/ а С=(Р²СО/РСО2)Fe3C / (Р²СО/ РСО2)С=(Р²СО/ РСО2) Fe3C·1/Кр.
Если принять для графита а С=1, то для метастабильного цементита активность должна быть выше:
а Fe3C>1;
(Р²СО/ РСО2) Fe3C>(Р²СО/ РСО2)C
Если активность углерода в углеродистых фазах железа выше, чем графита, то и содержания СО в газовой фазе оказывается больше, чем для реакции газификации углерода. Выявляется возможность взаимной оценки потенциала углерода для двух реагирующих фаз. Ранее отмечено, что потенциал углерода твердой фазы определяется величиной его активности:
p [С]=RT ln а С
тогда как его выражение для газовой фазы связано с содержанием в ней СО:
p [С](г.ф) = RT ln(Р²СО/ РСО2)– RT lnКр
Процессы науглероживания металла или его обезуглероживания развиваются в системе при наличии неравенства
p [С] ¹ p [С](г.ф).
и достигают равновесие при выравнивании потенциалов:
p [С] = p С
RT lnаС= RT ln(Р²СО/ РСО2) – RT lnКр
Это важное соотношение затруднительно выразить в количественной форме теоретическим путем. Необходимы данные по активностям углерода в фазах железа для различных содержаний углерода или экспериментальное определение равновесного состава газовой фазы. Для примерной оценки величины активности углерода могут служит соотношения, полученное М.И. Темкиным и Л.А. Шварцманом, а также Е.Шейлом из соображении ограниченного размещение атомов углерода вокруг атомов железа. Оно связано с повышением электронной плотности около атомов углерода, взаимодействующих с железом, что допускает заполнением углеродом только около 0,25 вакантных мест.
 Рис.7. Изменение активности углерода твердых фаз железа в зависимости от их состава.
Рис.7. Изменение активности углерода твердых фаз железа в зависимости от их состава.
Активности компонентов изменяются в зависимости от их атомных долей а растворе:
а С=Nc/(NFe–4 Nc)
а Fe=(NFe–4 Nc/ NFe)
Для последующего анализа равновесных данных реакции цементации железа важно оценить относительное изменение функций
а С=¦(Nc)
и
p[С]=ψ(Nc)
Для различных температурных уровней (t1. t2 и t3…) в зависимости от комбинации железоуглеродистых фаз. С этой целью сопоставляем диаграмму состояния Fe-C, отражающие области существования различных фаз, и соотношение РСО/ РСО2 газовой фазы, принятые за относительную меру активности углерода при Р=пост. (рис.7).
К средней однофазной области аустенита примыкают двухфазной области при наличии углеродсодержащих веществ, относительно которых устанавливается равновесное отношение РСО/ РСО2 газовой фазы. Для первого температурного уровня (t₁) на всем притяжений изменение общего содержания углерода сохраняются две конденсированные фазы (Feα +Fe3C). Для них правило фаз дает
РСО/ РСО2=¦(Т)
а при Т=пост РСО/ РСО2=пост, что свидетельствует о постоянстве аС независимо от количественного соотношения Feα и Fe3C. Для второго уровня (t₂) это постоянство сохраняется до границе аустенита с минимальным содержанием углерода Ан′. В области однофазного раствора аустинита между точками 1 и 2 по правилу фаз
РСО/ РСО2=¦(Т, Nc)
При Т=пост. соотношение РСО/ РСО2 и активность углерода в аустените возрастает с увеличением содержания углерода в аустените (Nc).
Условно на рис.7 принята прямолинейная зависимость. В действительности она более сложная и уточняется соотношением, установленным при изучении равновесии цементации:
ln а С=ln (Nc/NFe)+6,6 (Nc/ NFe)
Здесь Nc, NFe–атомные доли С и Fe. Стандартное состояние – разбавленный раствор, N®0. при выходе в двухфазную область существования Fe3C и Ан кривая показывает неизменность величины активности. Однако возможно осложнение, представленное для уровня (t4). Линия, ограничивающая слева аустенитную область, показывает одновременное повышение температуры и уменьшения углерода в насыщенном железом аустените А¢н. роль последнего главенствующего фактора может превзойти температурное влияние, и активность углерода в области Feα - А¢н оказывается на более низком уровне по сравнению с предшествующим уровнем для (t3). Важным следствием такого теоретического анализа является то, что для области существования двух конденсированных фаз равновесный состав газовой фазы и активность реагирующего углерода однозначно задаются температурой. Для однофазной области растворов переменной концентрации РСО/ РСО2, а также аС определяются не только температурой, но и концентрацией углерода. Все связанное справедливо при условии постоянства общего давления. Результате анализа согласуется мс данными экспериментальных исследовании цементации железа.
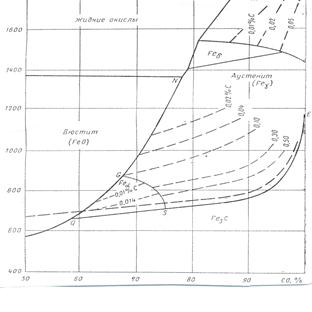 Рис.8. диаграмма равновесии науглероживания железа окисью углерода.
Рис.8. диаграмма равновесии науглероживания железа окисью углерода.
Ранние и довольно детальные исследования Иогенсена и Сета определили контуры равновесной диаграммы. Ее уточняют более поздние исследования, достоверность которых подтверждается работой Смитса. Имеющиеся данные в наиболее полном виде представлены для общего давления 1013,0·10² на рис 49. они отражает диаграмму состояния Fe-С с теми изменениями, которые неизбежны при переходе от одних координат к другим. Область равновесного существования 2 твердых фаз превратились в равновесную кривую, направление которой задается изменением содержания углерода в насыщенном растворе под влиянием температуры. Возможным вариантом реакций цементации соответствуют следующие равновесные кривые
2 → GS ~ Feα +А¢н ↔CO – СО2;
3 → SE ~ Fe3С+ А¢н ↔CO – СО2;
4 →SQ ~ Feα + Fe3С↔CO – СО2;
Каждая кривая показывает, как изменяется состав равновесной газовой фазы под влиянием изменения температуры для данной комбинации твердых фаз.
На рассматриваемой цементационной диаграмме сохраняется области реагирования однородных растворов феррита, аустенита и углеродистого расплава. Как показано выше, в каждой из них должна быть своя совокупность кривых, отражающая температурную зависимость состава газовой фазы для заданных содержаний углерода в растворе. Форма кривых связана с температурной функцией константы равновесия и отражает различное температурное воздействие на активность растворенного углерода:
а С=¦(Т).
По мере увеличения содержания углерода в растворе увеличивается активность углерода и кривые смещаются в сторону большого содержания СО в газовой фазе. Пределом смещения является SE, выражающая активность метастабильного Fe3С по сравнению с графитом. Для последнего пунктирная линия отмечает меньшие газификации.
Цементационная диаграмма позволяет судить об условиях науглероживания железа и составе конечного продукта при восстановительных процессах:
Науглероживание: (РСО/ РСО2)г.ф > (РСО/РСО2)р;
Обезуглероживания: (РСО/ РСО2)г.ф < (РСО/РСО2)р;
Заданная точка на диаграммном поле выражает условия реагирования (Т и РСО/РСО2) и, с другой стороны, состав конденсированных фаз, устойчивых в данной области. Если она задана в области устойчивости аустенита, то создаются условия восстановления железа до заданного аустенита либо обезуглероживания Fe3С до того же конечного продукта. Однако при понижении температуры исходная точка может сместиться в поле Fe3С, что обеспечивает предельное науглероживание. Таким же образом выявляются обезуглероживания железа. Наилучшим образом им отвечает область Feα и точки состава РСО/РСО2 вблизи области вюстита. Сама пограничная кривая, разделяющая области вюстита и аустенита, показывает условия предельно низкого науглероживания металла и появления окисной фазы. Она отражает одновременно протекающие превращения
3FeO+3CO=3Fe+3CO2
3Fe+2CO= Fe3С+ CO2
И равновесие суммарной реакции восстановления закиси железа в науглероженное железо (аустенит) или Fe3С ниже точки Q:
3FeO+5CO= Fe3С+ 4CO2
Для производственных процессов имеет значения система, в которой процессы науглероживания развиваются в присутствии твердого углерода. По условиям реагирования системы или в связи с адсорбцией углем значительных объемов газа реакции цементации будут развиваться при участии газовой фазы. Затрачиваемое при этом СО восполняется по реакции газификации углерода:
3FeO+2CO= Fe3С+CO2;
CO2+С=2СО.
Суммарный результат отражает расходование при этом углерода: 3Fe+C= Fe3С.
Таким образом, и в присутствии твердого углерода остаются в силе рассмотренные закономерности. Однако пределы науглероживания железа задаются положением равновесной кривой газификации углерода (пунктирная кривая). Для расширения пределов науглероживания и приближения к линии необходима более активная форма углерода по сравнению с графитом или его активирование добавками. Этому же служит некоторое понижение температуры.
При количественной оценке влияния давления выявляется интересная роль этого фактора. В общем, превращения развиваются до выравнивания потенциалов
реагирующих фаз:
p [С] =p [С](г.ф).
В выражении потенциала углерода газовой фазы p [С](г.ф) можно учесть влияние давления Р, привлекая выражение константы через объемные проценты:
p О (Г.Ф)= RT ln (%СО2)²/(%СО)·Р/100–RT lnКр
Для заданного отношения РСО/РСО2 газовой фазы увеличение давления вызывает возрастание потенциала газовой фазы p[С](г.ф) и более полное науглероживание металла. Однако возможна и другая оценка роли давления, когда задается конечный состав и потенциал конденсированной фазы, например при получении Fe3С:
p с (Fe3C) =пост.
С повышением давления Р увеличивается науглероживающая способность газовой фазы и заданный потенциал реализуется газовой фазой, относительно бедной по содержанию СО как источника углерода можно компенсировать повышением давления и, наоборот, науглероживающую роль СО можно значительно снизить применением разрежения. Такого рода предпосылки имеют значение для вакуумной металлургии при получении низкоуглеродистого металла.
Следствием рассматриваемых закономерностей является изменение положения цементационной диаграммы на графике (рис.49) при изменении общего давления. По мере его увеличения линии SE и SQ смещаются влево к неизменной границе области вюстита. При этом сужается область аустенита и при значительных давлениях создаются условия непосредственно восстановления FeO в Fe3С по реакции газовыми фазами, относительно бедными по содержанию СО. Для уменьшения науглероживания области аустенита, напротив, требуется разрежение. Все это представляет интерес для других металлов сродством к кислороду, которое можно оценить на основе экспериментальных определении констант равновесия реакций цементации с образованием карбидов Крц= Р²СО/РСО2 и получить термодинамические данные для образования карбидов:
хМе + С = МехС
Активность углерода в карбидах по равенству (54): а МеС=(Р²СО/РСО2)·1/Кр=Крц·1/Кр
Изменение ΔG° образования карбидов
ΔG°МеС= RT ln а С
ΔG°МеС=ΔG°С–ΔG°Ц;
ΔG°С и ΔG°Ц относится к реакциям газификации углерода и цементации металла.
Из соотношения (1) можно представить потенциал углерода карбидов и на этом основании сравнить их свойства:
p С(МеС) = ΔG°МеС= RT ln а С
|
|
Дата добавления: 2014-01-05; Просмотров: 487; Нарушение авторских прав?; Мы поможем в написании вашей работы!