
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие об активности электролитов, ионов и коэффициентах активности
|
|
|
|
Активность иона аi является функцией его концентрации в растворе, она отличается от концентрации на некоторый множитель, который
называется коэффициентом активности.
Концентрация раствора может быть выражена различно, например, молярность С, моль/л (т.е. числом молей на 1 л. раствора) или моляльностью m, моль/1000 г (т.е. числом молей на 1000 г растворителя). В соответствии с этим коэффициенты активности ионов будут иметь различное значение. Для того чтобы отразить зависимость коэффициента активности от способа выражения концентрации, вводят их различное обозначение. Это коэффициент активности, отнесённый к молярности, обозначают буквой f, к моляльности, обозначают буквой γ
 (9.4)
(9.4)
Согласно уравнению (9.4), коэффициенты активности индивидуальных ионов определяются выражениями:
 (9.4а)
(9.4а)
Коэффициент активности является мерой отличия свойств растворов электролитов (и вообще реальных растворов) от свойств идеальных растворов. Состояние идеального раствора достигается при бесконечном разбавлении, когда С → 0 (или m → 0) и fi → 1 (или γi→1).
Причины, вызывающие отклонение коэффициента активности ионов от единицы, а, следовательно, активности ионов от их концентрации в растворе, могут быть как физическими, так и химическими. В основном они могут быть сведены к двум:
1. изменение концентрации растворенного вещества вследствие диссоциации, ассоциации и сольватации, приводящих к изменению числа частиц в растворе;
2. изменение энергии растворенных частиц в связи с их взаимодействием между собой и с молекулами растворителя.
Вторая причина особенно проявляется в растворах сильных электролитов. Изменение энергии сильного электролита в сравнительно разбавленных растворах определяется, прежде всего, электростатическим взаимодействием ионов. В этом случае коэффициент активности γ < 1 не в связи с изменением числа частиц, а из-за изменения их энергии. В концентрированных растворах многих сильных электролитов коэффициент активности γ > 1, в этом случае его увеличение происходит в результате изменения свободной энергии вследствие гидратации ионов. В коэффициентах активности обе причины, вызывающие их отклонение, учитываются не раздельно, а суммарно.
|
|
|
С помощью величин коэффициента активности можно оценить свойства сильного электролита, у которого нет равновесия между молекулами и
ионами, а также слабого электролита, у которого это равновесие осуществляется (АВ ↔ А+ + В–). Например, в случае уксусной кислоты мы оцениваем активность всей кислоты по активности той части ее, которая находится в растворе в виде ионов. Таким образом, коэффициент активности отражает электростатическое взаимодействие ионов, их гидратацию, неполную диссоциацию, возможную ассоциацию ионов и другие эффекты.
Коэффициенты активности характеризуют силы межионного взаимодействия в условиях равновесия. Этому условию отвечают существующие методы определения коэффициентов активности (криоскопический метод, по упругости пара растворенного вещества или растворителя, измерения
электродвижущих сил (ЭДС) и т.д.). Наиболее важным и удобным является метод, основанный на определении ЭДС гальванических элементов, так как потенциалы электродов зависят от активности ионов, находящихся в растворе. Для этой цели могут быть использованы цепи как с переносом, так и без переноса.
Опытное нахождение активности или коэффициентов активности отдельно для катионов и анионов невозможно. Существующие методы позволяют экспериментально определить только среднюю активность ионов и средний коэффициент активности. Так как в любом растворе имеются
ионы противоположных знаков, получить катионы или анионы в изолированном виде невозможно, следовательно, нельзя определить активность отдельного иона исходя из опытных данных.
|
|
|
Даже в том случае, когда коэффициент активности ионов определяют путём измерения ЭДС, то получают средний коэффициент активности, так как ЭДС цепи зависит от свойств аниона и катиона. Поэтому и было введено понятие средней активности ионов, равное
 (9.5)
(9.5)
где m± − средняя моляльная концентрации ионов;
с± − средняя молярная концентрации ионов.
В физико-химических справочниках обычно приводят средние коэффициенты активности сильных электролитов γ± при моляльной концентрации m электролита. Для очень разбавленных растворов сильных электролитов
γ± = f±. В дальнейшем для разбавленных растворов будем пренебрегать различием между способом выражения коэффициента активности, что вполне допустимо при с ≤ 0,1. Для более концентрированных растворов между γ± и f± устанавливаются сложные зависимости.
Средняя активность а± и средний коэффициент активности f± электролита, диссоциирующего на n+ катионов и n– анионов, рассчитываются по аналогичным уравнениям:

(9.6)

и соответственно для бинарных электролитов типа КСI, NaCI, CuSO4 равны:
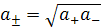
(9.7)

Средняя активность ионов H2SO4 равна корню кубическому из произведения квадрата активности ионов водорода на активность сульфат-ионов

а средний коэффициент активности равен:

Определение γ и α экспериментальными методами может быть выполнено путем измерения давления пара растворителя над раствором, температуры кипения, температуры замерзания, осмотического давления, ЭДС растворов, где α – активность всего электролита в целом (мольная активность); γ – коэффициент активности электролита. Методов определения активности отдельных катионов а+ и анионов а– не существует. Поэтому в физико-химии растворов сильных электролитов введено понятие о средней ионной
активности а± и среднем ионном коэффициенте активности γ±.
Для бинарных электролитов:
|
|
|


Общий случай: (9.9)


|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 2930; Нарушение авторских прав?; Мы поможем в написании вашей работы!