
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом водорода по квантово-механической теории
|
|
|
|
Атом водорода представляет собой систему, состоящую из одного электрона и одного протона, между которыми действует электростатическое притяжение. Потенциальная энергия электрона в поле ядра, в соответствии с законом Кулона, равна
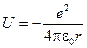 ,
,
где 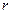 - расстояние от электрона до протона.
- расстояние от электрона до протона.
Уравнение Шредингера для этого случая имеет вид
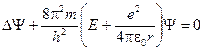 .
.
Решение его представляет довольно сложную задачу, поэтому ограничимся только описанием результатов:
1. Точное решение этого уравнения приводит к появлению дискретных энергетических уровней, обладающих теми же значениями энергии атома водорода, какие получались в теории Бора. Однако, в теории Бора этот результат был получен путем внесения постулатов. В квантово-механической теории он получается как следствие самой теории.
2. Точное решение уравнения Шредингера позволяет найти не только все энергетические уровни атома водорода, но и все волновые функции. Это решение показывает, что в основном состоянии электрон характеризуется одной волновой функцией 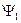 . В возбужденных состояниях электрона таких функций несколько. Квантовому числу
. В возбужденных состояниях электрона таких функций несколько. Квантовому числу 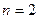 соответствуют четыре волновых функции, квантовому числу
соответствуют четыре волновых функции, квантовому числу  соответствуют девять значений и т.д., то есть, в общем случае, состоянию с квантовым числом
соответствуют девять значений и т.д., то есть, в общем случае, состоянию с квантовым числом  соответствует
соответствует 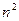 значений волновой функции.
значений волновой функции.
Таким образом, состоянию электрона с одним значением энергии соответствует несколько значений волновой функции. Эти значения отличаются между собой величиной вращательного момента импульса и значением его проекции на какое-либо произвольное направление.
Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии называется кратностью вырождения соответствующего энергетического уровня. Кратность вырождения уровней водорода равна 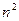 .
.
|
|
|
3. Решение уравнения Шредингера для атома водорода показывает также, что вращательный момент импульса электрона имеет ряд дискретных значений, определяемых по формуле:
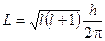 ,
,
где 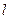 - коэффициент, называемый орбитальным квантовым числом. Он характеризует эксцентриситет орбиты электрона. Величина
- коэффициент, называемый орбитальным квантовым числом. Он характеризует эксцентриситет орбиты электрона. Величина 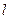 может принимать любые целые значения от 0 до
может принимать любые целые значения от 0 до 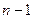 , где
, где 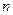 - главное квантовое число.
- главное квантовое число.
4. Решение уравнения Шредингера показывает, что проекция вращательного момента импульса на заданное направление равна:
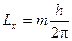 ,
,
где 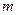 - коэффициент, называемый магнитным квантовым числом. Он определяет пространственную ориентацию орбиты электрона. Величина
- коэффициент, называемый магнитным квантовым числом. Он определяет пространственную ориентацию орбиты электрона. Величина 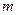 может принимать любые целые значения от
может принимать любые целые значения от 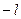 до
до 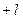 , включая 0. Итак, состояние электрона в атоме характеризуется тремя квантовыми числами
, включая 0. Итак, состояние электрона в атоме характеризуется тремя квантовыми числами 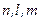 .
.
В атомной физике применяются заимствованные из спектроскопии условные обозначения состояний электрона с различными значениями момента импульс.
Численные значения квантового числа 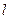 обозначают обычно буквами по следующей схеме:
обозначают обычно буквами по следующей схеме:
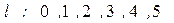
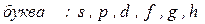 .
.
Электрон, находящийся в состоянии с 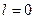 называют
называют 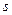 - электроном, с
- электроном, с 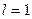 -
- 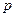 - электроном, с
- электроном, с 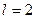 -
- 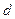 - электроном и т.д.
- электроном и т.д.
Электронные состояния принято записывать так: главное квантовое число 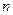 - цифрой, а число
- цифрой, а число 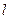 - соответствующей буквой. Например, электрон в состоянии с
- соответствующей буквой. Например, электрон в состоянии с  и
и 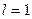 обозначается символом
обозначается символом 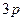 и т.д.
и т.д.
Поскольку 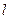 всегда меньше
всегда меньше 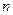 , возможны следующие состояния электрона
, возможны следующие состояния электрона
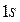
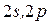
 о все энеретические уровни боладающих теми же значениями энергии ато
о все энеретические уровни боладающих теми же значениями энергии ато
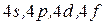 и т.д.
и т.д.
Энергетические переходы у атома водорода определяются только значениями главного квантового числа 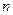 . Чтобы числа
. Чтобы числа 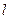 и
и 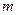 стали играть роль нужно снять «вырождение». Для атома водорода это можно сделать, помещая его в магнитное поле.
стали играть роль нужно снять «вырождение». Для атома водорода это можно сделать, помещая его в магнитное поле.
 Решая уравнение Шредингера, мы получаем данные о вероятности нахождения электрона в том или ином месте. При этом получается, что заряд электрона размазан с различной плотностью по всему атому, образуя электронное облако.
Решая уравнение Шредингера, мы получаем данные о вероятности нахождения электрона в том или ином месте. При этом получается, что заряд электрона размазан с различной плотностью по всему атому, образуя электронное облако.
|
|
|
Рассмотрим 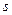 -состояние. Это состояние является основным состоянием атома водорода. В нем
-состояние. Это состояние является основным состоянием атома водорода. В нем 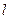 и
и 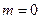 , и атом обладает минимальной энергией. Чтобы перевести атом из основного состояния в возбужденное, ему необходимо сообщит энергию. Это может быть осуществлено либо за счет теплового соударения атом, либо за счет столкновения атома с быстрым электроном, либо за счет поглощения атомом фотона.
, и атом обладает минимальной энергией. Чтобы перевести атом из основного состояния в возбужденное, ему необходимо сообщит энергию. Это может быть осуществлено либо за счет теплового соударения атом, либо за счет столкновения атома с быстрым электроном, либо за счет поглощения атомом фотона.
Фотон при поглощении его атомом передает ему всю свою энергию. Атом не может поглотить только часть фотона, так как фотон является неделимым. Поэтому атом может поглощать только те фотоны, энергия которых соответствует разности энергий двух его уровней. Это значит, что спектр поглощения атома водорода должен состоять из линий, соответствующих переходам:
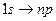
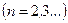 .
.
Этот результат полностью согласуется с опытом.
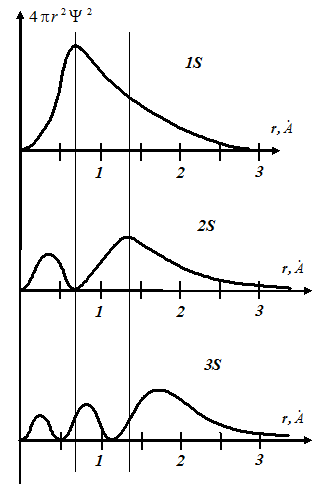
Вероятность нахождения электрона в шаровом слое для его различных энергетических состояний показана на графике.
Здесь по оси ординат отложена плотность этой вероятности 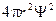 , а по оси абсцисс – радиус слоя.
, а по оси абсцисс – радиус слоя.
Как видно из графиков, в состоянии 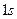 имеется один максимум электронной плотности. У атома водорода он находится на расстоянии
имеется один максимум электронной плотности. У атома водорода он находится на расстоянии 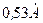 от ядра. В состоянии
от ядра. В состоянии 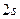 имеется два максимума электронной плотности, из которых наиболее посещаемым является дальний максимум. В состоянии
имеется два максимума электронной плотности, из которых наиболее посещаемым является дальний максимум. В состоянии 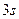 имеется три максимума электронной плотности.
имеется три максимума электронной плотности.
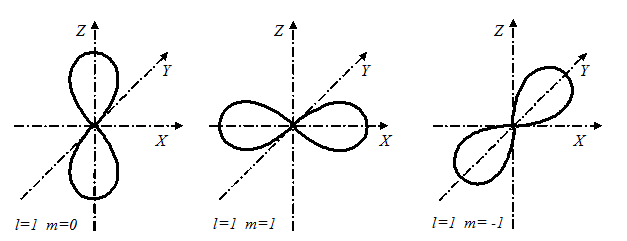 В
В 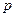 -состояниях, как показывает решение уравнения Шредингера, распределение плотности электронного облака имеет вид:
-состояниях, как показывает решение уравнения Шредингера, распределение плотности электронного облака имеет вид:
Значения 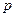 могут быть любыми. Различие в главном квантовом числе сказывается на изменении размеров картины: чем больше
могут быть любыми. Различие в главном квантовом числе сказывается на изменении размеров картины: чем больше 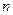 , те больше растянется картина.
, те больше растянется картина.
В 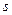 - состояниях вероятность
- состояниях вероятность 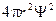 имеет максимум на таком расстоянии от ядра, которое совпадает с радиусом орбиты электрона в атоме. В соответствии с основным положением квантовой теории, энергия атома квантуется, то есть может принимать ряд дискретных значений. Так как эта энергия зависит от проекции магнитного момента на направление поля, то эта проекция квантуется по следующему правилу: величина проекции сопоставляется с квантовым числом
имеет максимум на таком расстоянии от ядра, которое совпадает с радиусом орбиты электрона в атоме. В соответствии с основным положением квантовой теории, энергия атома квантуется, то есть может принимать ряд дискретных значений. Так как эта энергия зависит от проекции магнитного момента на направление поля, то эта проекция квантуется по следующему правилу: величина проекции сопоставляется с квантовым числом 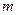 , которое может принимать только целочисленные положительные и отрицательные значения от
, которое может принимать только целочисленные положительные и отрицательные значения от 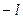 до
до 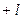 , включая нуль.
, включая нуль.
|
|
|
Это значит, что
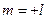 ;
;  ; ….0….
; ….0….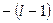 ;
; 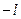 .
.
Следовательно, 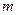 может иметь всего
может иметь всего 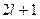 значений.
значений.
При тщательном исследовании спектров оказалось, что спектральные линии имеют тонкую структуру, наблюдаемую и в отсутствие внешних полей. Так, например, все линии спектра водорода оказались состоящими из двух отдельных близко расположенных линий.
Для объяснения этого явления Юленбеком и Гаудсмитом была высказана гипотеза о наличии у электрона собственного момента количества движения или «спина». Подобно орбитальному моменту импульса спин электрона и его проекция на ось, совпадающую с направлением внешнего магнитного поля, должны быть квантованы. В квантовой механике доказывается, что спин электрона должен быть квантован по закону
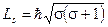 ,
,
где 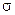 - спиновое квантовое число, соответствующее орбитальному квантовому числу в теории Шредингера. Число различных проекций момента количества движения на ось, совпадающую с направлением поля, равно
- спиновое квантовое число, соответствующее орбитальному квантовому числу в теории Шредингера. Число различных проекций момента количества движения на ось, совпадающую с направлением поля, равно 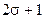 .
.
Откуда  .
.
Спиновое квантовое число имеет только одно значение и этим отличается от главного, орбитального и магнитного квантовых чисел.
Численное значение спина электрона равно
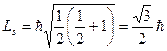 .
.
Итак, состояние электрона в атоме характеризуется четырьмя квантовыми числами: главным, орбитальным, магнитным и спиновым.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3363; Нарушение авторских прав?; Мы поможем в написании вашей работы!