
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое строение ферментов
|
|
|
|
ФЕРМЕНТЫ
Вещества белковой природы, биологическая функция которых состоит в катализе, т.е. ускорении течения химических реакций в организме, называются ферментами.
К настоящему времени идентифицировано более трех тысяч различных ферментов, из которых более 1000 ферментов получено в кристаллическом виде и изучены их свойства.
Успехи, достигнутые в изучении строения и функции ферментов, позволяют считать, что ферменты являются тем рабочим аппаратом, при помощи которого реализуется генетическая информация, зашифрованная в последовательности нуклеотидов ДНК, и совершается обмен веществ и энергии.
Складываясь в единый ансамбль биохимических процессов, ферментативные реакции преобразования веществ составляют материальную и энергетическую основу жизнедеятельности организма. Поэтому ферменты заслуженно считают двигателями всех жизненных процессов. Блокирование деятельности ферментов микробными токсинами и иными ядами ведет к гибели организма.
На свойстве ферментов сохранять свои специфические функции вне организма основано их практическое применение в медицине, химической, пищевой, легкой и фармацевтической промышленности.
По химическому строению ферменты могут быть протеинами (т.е. простыми белками) и протеидами (сложными белками). Если активность ферментов-протеинов зависит только от структуры самого белка, то активность ферментов-протеидов связана с присутствием групп небелковой природы – так называемых кофакторов.
В роли кофакторов могут выступать или ионы металлов или органические соединения, входящие, как добавочная группа небелковой природы, в состав фермента-протеида.
Фермент в целом получил название фермент-протеид или симплекс, или холофермент; белковая часть получила название белковый компонент или ферон (носитель), или апофермент; наконец, добавочная группа получила название простетическая группа или агон (активная группа) или кофермент.
|
|
|
Кофакторы, как правило, термостабильны, тогда как большинство ферментов при нагревании инактивируется.
Связывание кофакторов с ферментами характеризуется разной степенью сродства.
Под простетической группой часто подразумевают добавочную группу, прочно связанную, не отделяемую от белковой части. Примером может служить гемогруппа цитохрома С, ковалентно связанная с его полипептидной группой.
Под коферментом подразумевают добавочную группу, легко отделяющуюся от апофермента, обслуживающую два или несколько ферментов и способную к самостоятельному существованию. Так, коферменты НАД и НАДФ соединены с апоферментом только в период переноса протонов и электронов от субстрата на кофермент. После этого они отщепляются и находятся в жидкостях клеток в свободном состоянии. Коферменты играют роль промежуточных переносчиков электронов и протонов (первая группа коферментов), различных химических групп (аминогрупп, метильных, ацетильных групп и др.) – вторая группа коферментов, наконец, принимает участие в реакциях синтеза, изомеризации и расщепления С-С – связей (третья группа коферментов)
Роль коферментов в ферментах-протеидах играют большинство витаминов и витаминоподобных веществ (Q, В1, В2, В5, В6, B12, Вc и др.) или соединения, построенные с участием витаминов (кофермент А, НАД, НАДФ, ФАД). К настоящему времени известно свыше 300 отдельных ферментов, в состав которых входят в качестве коферментов витамины и их производные. Поэтому при гиповитаминозах нарушается деятельность многих ферментных систем.
В качестве примера приведены коферменты никотинамидадениндинуклеотид, тиаминпирофосфат
|
|
|
Коферменты никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ), переносящие водородные атомы, содержат витамин В5 (никотинамид).
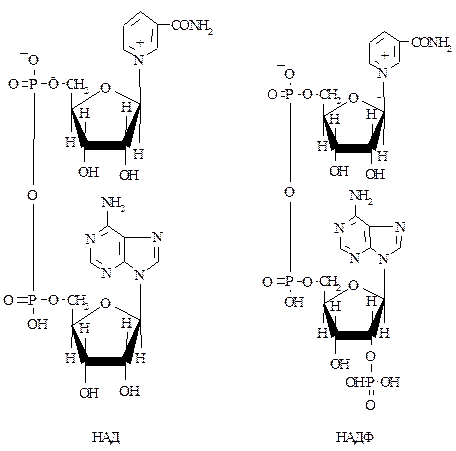 |
Кофермент тиаминпирофосфат (ТПФ), участвующий в переносе альдегидных групп и декарбоксилировании кетокислот, является фосфорным эфиром витамина В1 (тиамина). ТПФ в качестве кофермента входит в состав пируватдегидрогеназы, α-кетоглутаратдегидрогеназы, транскетолазы.
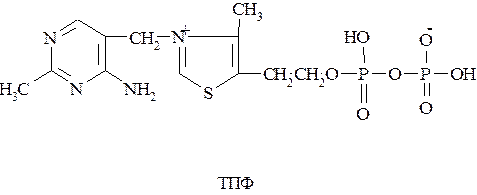 |
Наряду с витаминами, функцию коферментов выполняют некоторые пептиды, например, НS-глутатион (γ-глутаминилцистеинилглицин), принимающий участие в окислительно-восстановительных процессах в клетках, а также многочисленная группа нуклеотидов и их производных (аденозиновые, гуанозиновые, уридиновые, цитидиновые нуклеотиды). В частности, аденозинтрифосфат (АТФ) является переносчиком остатков фосфата и адениловой кислоты, 3’-фосфоаденозин-5’-фосфосульфат (ФАФС) – переносчиком сульфатных групп, S-аденозилметионин-переносчиком метильных групп, уридиндифосфат (УДФ) – переносчиком гликозидных остатков и уроновых кислот в виде УДФГ и УДФГК, цитидиндифосфат (ЦДФ) – переносчиком фосфохолина (в виде ЦДФХ).
Транспортные РНК являются коферментом аминоацил-т-РНК-синтетазы – фермента, активирующего и переносящего аминокислоты в процессе биосинтеза белка. Наконец, коферментами могут служить фосфорные эфиры некоторых моносахаридов (глюкозо-1,6-дифосфат; 2,3-дифосфоглицерат), липоевая кислота, металлопорфирины (гем) и ряд других веществ, а также ионы металлов.
Характерной особенностью ферментов-протеидов является то, что ни белковая часть (т.е. апофермент), ни добавочная группа (кофермент) по отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет выраженные ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная группа, в свою очередь, стабилизирует белковую часть и делает ее более стойкой к денатурирующим воздействиям. Непосредственным исполнителем каталитической функции ферментов-протеидов является добавочная группа (кофермент, простетическая группа, ионы металлов), выступая в роли активного центра фермента, но ее действие невозможно без участия полипептидных фрагментов белковой части фермента, которая определяет специфичность реакции на этапе фиксации субстрата. Другая особенность ферментов-протеидов состоит в том, что один и тот же кофермент, присоединяясь к различным белкам, может катализировать совершенно различные процессы. Так, пиридоксальфосфат в одном случае ускоряет трансаминирование, а в другом – декарбоксилирование аминокислот. Различный характер реакций связан с разницей в природе соответствующих апоферментов.
|
|
|
Иначе обстоит дело у ферментов-протеинов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с субстратом (т.е. преобразуемым соединением). Считают, что эту функцию выполняет часть белковой молекулы, получившая название активного (каталитического) центра.
Предполагается, что активный центр фермента-протеина представляет собой уникальное сочетание определенных аминокислотных остатков, входящих в состав полипептидной цепи фермента.
Аминокислотные остатки, образующие активный центр фермента-протеина, расположены в различных точках единой полипептидной цепи. Поэтому активный центр формируется в тот момент, когда белковая молекула приобретает присущую ей третичную структуру, что приводит к пространственному совмещению функциональных групп необходимых для катализа, в активном центре.
Изменение третичной структуры белка-фермента под влиянием тех или иных факторов может привести к деформации активного центра и к изменению каталитической активности.
Кроме активного центра, у ферментов различают еще два: субстратный и аллостерический центры.
Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества, подвергающегося ферментативному превращению (т.е. субстрата).
Аллостерический центр представляет собой участок молекулы фермента, пространственно отделенный от активного центра, присоединение к которому определенного низкомолекулярного вещества (лиганда, эффектора) ведет к изменению третичной структуры белковой молекулы. Последнее, в свою очередь, ведет к изменению конфигурации активного центра, сопровождающееся увеличением или уменьшением каталитической активности фермента.
|
|
|
Размеры молекул ферментов различны. Молекулярные массы ферментов колеблются от нескольких тысяч до миллионов. Многие ферменты представлены белками высокой молекулярной массы, построенными из субъединиц и называемыми мультиэнзимами.
Построенный из субъединиц фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента, а в ряде случаев изменяет его специфичность.
Молекулы ферментов-мультимеров составлены, как правило, из субъединиц (протомеров) двух типов и образуют изомеры.
В клетках организма ферменты функционируют обычно в составе мультимерных систем или комплексов, катализирующих определенные последовательности биохимических реакций. При этом продукт, полученный при участии первого фермента, оказывается в роли субстрата для следующего фермента и т.д.
Такие системы часто организованы в виде комплексов, состоящих из нескольких ферментов.
Мультиэнзимные комплексы могут быть связаны с мембранами или клеточными органеллами. Хорошим примером такой мультиферментной системы является цепь дыхательных ферментов, осуществляющих перенос электронов с субстрата на кислород.
Вообще следует подчеркнуть, что в клеточном содержимом ферменты распределены не хаотически, а строго упорядоченно.
Системы ферментов сосредоточенные в тех или иных структурах клетки, обеспечивают осуществление отдельных циклов реакций. Благодаря такой структуре ферментных систем процесс ферментативного катализа представляется как серия последовательных элементарных превращений вещества, строжайшим образом организованных в пространстве и времени, и тем самым обеспечивают жизнедеятельность клеток, тканей и органов.
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 3809; Нарушение авторских прав?; Мы поможем в написании вашей работы!