
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дисперсні системи
|
|
|
|
І. ПОВЕРХНЕВІ ЯВИЩА
ВСТУП
У вигляді самостійної науки колоїдна хімія сформувалася у 60х-р XІX сторіччя. Англійський хімік Томас Грем дослідив аномальні властивості деяких розчинів: розсіювання світла; випадіння осаду при додаванні солей; повільну дифузію, невеликий осматичний тиск та ін., які він назвав колоїдами. Особливі властивості речовин, обумовлених їх роздрібленістю на сучасному етапі вивчає колоїдна хімія – наука про дисперсні системи та поверхневі явища. Великий внесок у розвиток колоїдної хімії зробили А.В. Думанський, П.А. Ребіндер, Б.В. Дерягін. На основі їх розроблень одержали теоретичні і прикладні аспекти, різні розділи колоїдної хімії.
Сучасна колоїдна хімія суттєво розширила сферу своєї «діяльності» і перетворилася в одну із фундаментальних хімічних наук. Колоїдно-хімічні закономірності виявляються у різноманітних галузях промислового і сільскогосподарського виробництва; рослинному і тваринному світі; навколишньому середовищі.
Колоїдна хімія є базовою дисципліною, яка визначає становлення висококваліфікованого фахівця з охорони навколишнього середовища, тому що знання властивостей дисперсних систем і поверхневих явищ сприяє виникненню безвідходних технологій, раціональному використанню сировини, одержанню матеріалів із заданими властивостями. Все це поліпшує екологічний стан довкілля.
Конспект лекцій розрахований на засвоєння основ колоїдної хімії на сучасному рівні, що допоже при вивченні дисциплін спеціальних курсів.
Колоїдна хімія – наука про дисперсні системи і поверхневі явища. Колоїдно-хімічні закономірності виявляються у рослинному і тваринному світі, практично в усіх сферах діяльності людини.
|
|
|
У сучасної колоїдної хімії об’єктом вивчення є дисперсні системи, які складаються з двох чи більше фаз, тобто гетерогенні. Роздрібнена (переривна) частка дисперсної системи носить назву дисперсної фази, а нероздріблена (безпереривна) – дисперсійне середовище. Поміж ними виникає межа поділу фаз. Необхідною умовою утворення дисперсних ситем є нерозчинність чи обмежена взаємна розчинність дисперсної фази і дисперсійного середовища.
Мірою роздрібленості дисперсної системи вважають розмір частинок 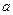 дисперсної фази чи величину обернену розміру частинки
дисперсної фази чи величину обернену розміру частинки 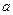 , яку називають дисперсністю
, яку називають дисперсністю 

Для сферичних частинок питома поверхня дорівнює
 ,
,
де  - питома поверхня розділу фаз, яка дозволяє кількісно визначити фактичну межу між дисперсною фазою і дисперсійним середовищем (
- питома поверхня розділу фаз, яка дозволяє кількісно визначити фактичну межу між дисперсною фазою і дисперсійним середовищем (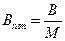 ,
,  , де
, де 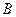 - поверхня розділу фаз,
- поверхня розділу фаз,  - одиниця маси дисперсної фази);
- одиниця маси дисперсної фази);  - дисперсність;
- дисперсність;  - густина матеріалу частинок дисперсної фази.
- густина матеріалу частинок дисперсної фази.
Класифікація дисперсних систем проводиться:
а) залежно від агрегатного стану дисперсної фази і дисперсійного середовища (табл. 1.1).
Дисперсійним середовищем можуть бути рідина (Р), тверде тіло (Т), газ (Г). Можливо дев’ять видів дисперсних систем. Внаслідок розчинності газів системи типу Г/Г, звичайно, не розглядаються. У чисельнику показується агрегатний стан дисперсної фази, а у знаменнику – дисперсійного середовища.
Таблиця 1.1 – Класифікація дисперсних систем за агрегатним станом (В. Оствальд).
| Дисперсні системи | |
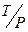
| Золі, суспензії, гелі, пасти (фруктові соки, овочеві пасти, косметичні засоби) |
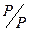
| Емульсії, креми (молоко, маргарин, майонез, косметичні креми). |

| Газові емульсії, пени (шипучі напої, ігристі вина) |

| Тверді золі, сплави (ковбаса, шоколадна маса) |

| Тверді емульсії, пористі тіла (пемза, кондитерські маси) |

| Тверді пени, пористі тіла (туф, хліб, сир) |

| Дим, пил (промислові викиди, пил мукушольної, крупяної, камнепереробної промисловості) |

| Туман |
|
|
|
б) залежно від розміру частинок (табл. 1.2). Розрізняють два основні класи систем: високодисперсні та грубодисперсні. Проміжними є середньодисперсні системи.
Таблиця 1.2 – Класифікація дисперсних систем залежно від розміру частинок
| Клас | Розмір частинок, м | Дисперсність, м-1 |
| Високодисперсні | 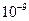 – – 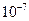
|  – – 
|
| Середньодисперсні | 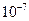 – – 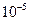
|  – – 
|
| Грубодисперсні | 
| 
|
Властивості високодисперсних та грубодисперсних систем мають відмінності, але дисперсність і роздрібленість є загальним і об’єднує ці системи. Змінення властивостей при переході високодисперсних систем у грубодисперсні відбувається повільно через середньодисперсні системи, що можна показати графічно (рис. 1.1).
Зі збільшенням дисперсності інтенсифікуються молекулярно-кінетичні явища (броуновський рух, дифузія, осмос); питома поверхня збільшується; прискорюються фізико-хімічні процеси на межі поділу фаз; зменшується швидкість седиментації.
Існує ще і третя ознака, за якою класифікують дисперсні системи, що зумовлена видами дисперсних фаз. Дисперсну фазу можуть складати плівки, мембрани, капіляри чи нитки. Розрізняють тривимірні (частинки), двовимірні (нитки, волокна, капіляри, пори) та одновимірні (плівки, мембрани) дисперсні фази.
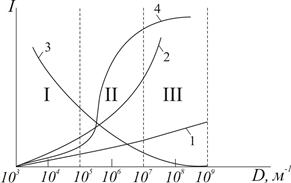
Рисунок 1.1 – Змінення інтенсивності властивостей дисперсної системи 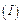 залежно від дисперсності
залежно від дисперсності 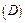 : 1 – молекулярно-кінетичних; 2 – питомої поверхні; 3 – швидкості седиментації;
: 1 – молекулярно-кінетичних; 2 – питомої поверхні; 3 – швидкості седиментації;
4 – фізико-хімічних. І, ІІ, ІІІ – грубодисперсні, середньодисперсні і високодисперсні системи відповідно.
Для тривимірної дисперсної фази розрізняють:
- чисельну (часткову) концентрацію, яка визначається числом частинок  дисперсної фази в одиниці об’єму
дисперсної фази в одиниці об’єму 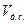 дисперсної системи
дисперсної системи
 ,
,  ;
;
- масову концентрацію, яка характеризує масу дисперсної фази  в одиниці об’єму дисперсної системи
в одиниці об’єму дисперсної системи
 ,
,  ;
;
- об’ємну концентрацію, що показує, яка частка об’єму дисперсної системи 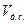 приходиться на об’єм дисперсної фази
приходиться на об’єм дисперсної фази 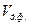
 чи
чи  .
.
Залежно від умов і властивостей дисперсних систем для виразу концентрації дисперсної фази використовують різні величини. Наприклад, вміст дисперсної фази в емульсіях подають у вигляді об’ємної концентрації 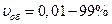 ; вміст пилу у повітрі виражають чисельною чи масовою концентрацією. Між ними існує математична залежність
; вміст пилу у повітрі виражають чисельною чи масовою концентрацією. Між ними існує математична залежність
|
|
|
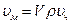 ,
,
де  − об’єм однієї частинки,
− об’єм однієї частинки,  − густина матеріалу частинки відповідно.
− густина матеріалу частинки відповідно.
Залежно від співвідношення розмірів частинок дисперсної фази є монодисперсні (частинки одного розміру) і полідисперсні (частинки розрізняються за розміром і кількістю частинок одного розміру). Для частинок неправильної форми використовують еквівалентний розмір , який визначається різноманітними методами.
, який визначається різноманітними методами.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 970; Нарушение авторских прав?; Мы поможем в написании вашей работы!