
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амальгамы. Амальгама - металлическая система, одним из компонентов которой является Hg (ранее - сплав Hg с металлом - не опредеделяло характера взаимодействия).
|
|
|
|
Амальгама - металлическая система, одним из компонентов которой является Hg (ранее - сплав Hg с металлом - не опредеделяло характера взаимодействия).
Растворимость металлов (Ме) в Hg: 1) выше 10% - Tl; 2) от 1 до 10% - Cs, Rb, Cd, Zn, In, Pb, Bi; 3) от 0,1 до 1%: Na, K, Mg, Ca, Sr, Ba, Sn; 4) от 0,01 до 0,1% - Li, Ag, Au, Th; 5) от 0,001 до 0,01 % - Cu, Al, Mn; 6) крайне нерастворимы - Be, Ge, Ti, Zr, As, Sb, V, Ta, Cr, Mo, W, U, Fe, Ni, Co. Растворимость Ме в Hg связана с межатомными взаимодействиями атомов Ме и Hg и разрушением вследствие этого кристаллической решетки Ме. Природа и энергия межатомной связи в кристаллической решетке Ме имеют определяющее значение. Здесь значительное влияние оказывают термодинамические и физические свойства Ме (теплота плавления, испарения, сублимации, твёрдость), которые зависят от положения Ме в периодической системе Менделеева.
Образование интерметаллических соединений со скачкообразным изменением свойств: с повышенной температурой плавления (MgHg, NaHg, KHg, LiHg и др.); с полупроводниковыми свойствами (HgS, HgSe, HgTe и др.); со сверхпроводящими свойствами (HgIn, HgSn, HgCd, KHg3, NaHg4 и т.д.).
Типы связей в интерметаллических соединениях: 1 тип связи - молекулярная связь (в результате поляризации атомов под действием разносимметричных зарядов - силы электростатической природы - Ван-дер-Ваальса); 2 тип связи - ионная (или полярная) - атомы в виде ионов находятся в кристалле (разноимённые заряды - притяжение), например, NaCl; 3 тип связи - ковалентная или гомополярная - однородные атомы соединяются так, что внешние орбиты составляют единую систему, включающую 2 электрона, вращающиеся вокруг 2-х элементов: H2, N2, O2, Cl2 - распад ковалентной связи даёт нейтральные атомы; 4 тип связи - металлическая связь (в металлах и сплавах) - насыщение валентности металла происходит за счёт обобщения всех имеющихся электронов, что обеспечивает высокую электрическую проводимость и большую степень деформации.
Классификация амальгам (А): тип 1- А с Ме, не растворимыми в ртути (Fe, Ni, Co, Mn, Cr, Al) - получаются электролитическим путём при потенциалах, более отрицательных по сравнению с чистыми Ме; тип 2 - А «цинкового типа» с Ме, хорошо растворимыми в Hg (Zn, Cd, Tl, Pb, Sn, In, Bi) - получаются электролитическим путём на твёрдых катодах при потенциалах, близких к потенциалу Ме; тип 3 - А «натриевого» типа, дающие с Hg химические соединения (Na, Li, K, Rb, Cs, Mg и редкие Ме). А по типу 1 имеют частицы с размерами 2÷5мкм, образующие суспензию в Hg. Крупные частицы А по типу 1 получаются в автоклавах при повышенной температуре методом прямого контакта с Hg (U, Th, Ti, Zr, Al и др.). А по типу 2 - гомогенные жидкие растворы при комнатной температуре для высокорастворимых Ме, а для малорастворимых Ме - А в виде пастообразных суспензий частиц Ме в Hg или интерметаллических соединений в насыщенном растворе Hg.
Способы получения амальгам: 1) непосредственный контакт Ме с Hg при комнатной или повышенной температуре – процесс начинается со смачивания ртутью Ме, при этом кинетика зависит от состояния поверхности и дисперсности Ме (особую роль играет окисная плёнка, для Ме, на которых она легко образуется, лучше процесс проводить в вакууме или в среде инертного газа); 2) метод электролиза – может применяться для любых А, а для хорошо растворимых Ме могут быть получены «истинные» А – растворы Ме в Hg.
Применение амальгам в источниках света: 1) высокотемпературные А (оптимальное РHg = 6 10-3 мм рт.ст. обеспечивается при температуре 60-100оС) на основе In или Cd (более 50%) с добавлением Pb, Sn, Bi, Zn при содержании Hg 10÷30% (% весовые) – только In и Cd снижают РHg по сравнению с таковым для чистой Hg, они имеют в соединениях с Hg отрицательное отклонение от закона Рауля; 2) низкотемпературные А (оптимальное РHg = 6 10-3 мм рт.ст. обеспечивается при температуре 38÷42оС) на основе Pb, Sn, Bi, Zn, возможно с небольшими добавками In или Cd; 3) А на основе Na (см. выше пункт по щелочным Ме) для ламп ДНаТ. В А по п.1 добавление Pb, Sn, Bi, Zn делается для управления такими свойствами как пластичность (хрупкость), температуры размягчения и плавления, они применяются для всех типов трубчатых ЛЛ, в том числе компактных (КЛЛ) с тяжелым тепловым режимом (повышенной мощности или работающих в закрытых светильниках). А по п.2, имеющие положительное отклонение от закона Рауля, применяются для повышения экологических свойств (у производителей и у потребителей) всех типов ЛЛ и КЛЛ, эксплуатирующихся в открытых светильниках и имеющих наиболее холодную зону с температурами 30÷50оС. А по п.3 изготавливается под защитным слоем нейтральной жидкости, в инертном газе или вакууме, также они должны и храниться, иначе металлы (особенно в жидкой А) могут целиком перейти в окислы или гидраты.
Закон Рауля (применим к разбавленным растворам) – давление пара раствора ниже давления пара чистого растворителя на величину, пропорциональную концентрации растворённого вещества, и определяется уравнением: (РА - РАS) / РА= хВ = nB / (nA+ nB), где РА , РАS – давления паров чистого растворителя и раствора, хВ - молярная доля растворённого вещества в растворе, nA и nB – количество молей растворённого вещества и растворителя, соответственно. Так как хА = nA/(nA+nB), то aA = РАS / РА = хА, где aA – активность вещества А в растворе.
Для амальгам закон Рауля можно записать так: 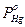 = xHg PHg, где xHg - концентрация Hg в амальгаме,
= xHg PHg, где xHg - концентрация Hg в амальгаме, 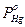 и PHg – давления пара Hg над амальгамой и над чистой Hg, соответственно. Для реальных растворов:
и PHg – давления пара Hg над амальгамой и над чистой Hg, соответственно. Для реальных растворов: 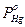 = = аHg, где аHg – активность Hg в амальгаме - это термодинамическая характеристика, которая является производной для определения других термодинамических характеристик (свободной энергии, энтропии, энтальпии). При аHg < 1 можно получать
= = аHg, где аHg – активность Hg в амальгаме - это термодинамическая характеристика, которая является производной для определения других термодинамических характеристик (свободной энергии, энтропии, энтальпии). При аHg < 1 можно получать 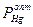 при температурах > 38÷42оС.
при температурах > 38÷42оС.
Требования к амальгамообразующим металлам: 1) способность образовывать А, в которых аHg < 1; 2) иметь низкое давление собственного насыщенного пара; 3) не вступать в химическое взаимодействие с материалами ЛЛ как при изготовлении ЛЛ, так и при их работе; 4) иметь необходимые температуры плавления, пластичность (твёрдость), химическую устойчивость в процессе изготовления, интенсивность амальгамообразования (для А, образующихся в ЛЛ после их изготовления); 5) приемлемая стоимость. Анализ данных по растворимости Ме в Hg, диаграмм состояний Ме-Hg и технологии получения А позволяет рекомендовать следующие наиболее приемлемые для получения А металлы: Zn, Cd, In, Tl, Sn, Pb, Bi.
Термодинамические свойства бинарных систем: Zn-Hg: Положительное отклонение от закона Рауля в системе Zn-Hg объясняется ассоциацией атомов Zn по уравнению: 2Zn = Zn2. При хZn = 0,3 и t = 335оС имеет место максимальное значение энтальпии смешения (430 Дж/(г · ат)); Cd-Hg: Активность Cd и Hg в жидком состоянии показывает отрицательное отклонение от закона Рауля ввиду взаимодействия компонентов с образованием интерметаллических соединений. Значение tопт ↑ с увеличением хCd в А (при 48%вес Cd - 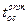 ↑ c 25 до 45оС); In-Hg: Система характеризуется образованием ряда интерметаллических соединений в твёрдом состоянии. Активность In и Hg проявляется отрицательным отклонением от закона Рауля (при хHg от 0,05 до 0,6 – отрицательное отклонение с максимальным значением при хHg = 0,2,
↑ c 25 до 45оС); In-Hg: Система характеризуется образованием ряда интерметаллических соединений в твёрдом состоянии. Активность In и Hg проявляется отрицательным отклонением от закона Рауля (при хHg от 0,05 до 0,6 – отрицательное отклонение с максимальным значением при хHg = 0,2, 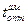 при хHg = 0,1 – 0,2 не зависит от хHg); Tl-Hg: Изотермы активности Tl и Hg показывают незначительное отрицательное отклонение от закона Рауля; Sn-Hg: У жидких сплавов системы Sn-Hg имеется существенное положительное отклонение от закона Рауля (890 Дж/(г·ат) при хSn = 0,3); Pb-Hg: Активность Hg (аHg) характеризуется положительным отклонением от закона Рауля во всей области составов. Активность Pb (aPb) при низком содержании Pb имеет положительное отклонение, а для составов, богатых Pb, наблюдается значительное отрицательное отклонение – это объясняется существованием в твёрдом состоянии интерметаллического соединения Pb2Hg, оказывающего влияние на свойства жидких амальгам; Bi-Hg: При 321оС аHg при хHg = 0,6 проявляется положительное отклонение от закона Рауля, а при хHg = 0,4 поведение Bi в амальгаме соответствует идеальному раствору.
при хHg = 0,1 – 0,2 не зависит от хHg); Tl-Hg: Изотермы активности Tl и Hg показывают незначительное отрицательное отклонение от закона Рауля; Sn-Hg: У жидких сплавов системы Sn-Hg имеется существенное положительное отклонение от закона Рауля (890 Дж/(г·ат) при хSn = 0,3); Pb-Hg: Активность Hg (аHg) характеризуется положительным отклонением от закона Рауля во всей области составов. Активность Pb (aPb) при низком содержании Pb имеет положительное отклонение, а для составов, богатых Pb, наблюдается значительное отрицательное отклонение – это объясняется существованием в твёрдом состоянии интерметаллического соединения Pb2Hg, оказывающего влияние на свойства жидких амальгам; Bi-Hg: При 321оС аHg при хHg = 0,6 проявляется положительное отклонение от закона Рауля, а при хHg = 0,4 поведение Bi в амальгаме соответствует идеальному раствору.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 952; Нарушение авторских прав?; Мы поможем в написании вашей работы!