
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля
|
|
|
|
Закон Генри
Растворение газов в воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается.
При растворении газа в жидкости устанавливается равновесие:
Газ + Жидкость Û Насыщенный раствор
При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа.
Генри сформулировал эту закономерность в более общем виде: парциальное давление пара растворенного вещества над раствором пропорционально молярной доле растворенного вещества в растворе (закон Генри):
P = kX, (43)
где k - константа Генри (или коэффициент Генри).
Следствие из закона Генри: объем газа, растворяющегося при постоянной температуре в данном объеме жидкости, не зависит от его парциального давления.
Газы подчиняются закону Генри при невысоких давлениях и в случае отсутствия химического взаимодействия между молекулами газа и молекулами растворителя.
При данной температуре давление насыщенного пара над жидкостью - величина постоянная. При растворении какого-либо вещества в данной жидкости давление насыщенного пара этой жидкости над раствором понижается, т. е. давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность этих давлений получила название понижение давления пара над раствором.
В 1887 г. французский физик Рауль установил закон, связывающий понижение давления пара (над разбавленными растворами неэлектролитов) с концентрацией растворенного вещества (закон Рауля): относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:
|
|
|
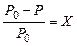 . (44)
. (44)
Явление уменьшения давления пара растворителя над раствором можно объяснить следующим образом. Равновесие между водой и паром выражается схемой (Н2О)жидк = (Н2О)пар. Если теперь растворить в воде некоторое количество вещества, то концентрация молекул воды в растворе уменьшится и пойдет процесс, который её увеличивает, т. е. процесс конденсации пара. Новое равновесие устанавливается при более низком давлении насыщенного пара растворителя.
Рис. 18
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 747; Нарушение авторских прав?; Мы поможем в написании вашей работы!