
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Моль, число Авогадро
За единицу количества вещества принят моль – количество вещества, содержащее столько же структурных единиц (атомов, ионов, молекул и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12С. Число частиц, содержащиеся в одном моле вещества, называют числом Авогадро (Постоянной Авагадро) NA. Это одна из универсальных постоянных, которая не зависит от природы вещества и внешних условий.
NA ≈ 6,022.1023 моль-1 (60 способов определения).
Количество вещества, выраженное в молях, связано с его массой величиной, называемой молярной массой вещества.
Молярная масса численно равна молекулярной:
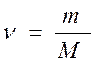 ; г/моль
; г/моль
Кислород (О2)– относительная молекулярная масса 32 у.е. и молярная масса – 32 г/моль. Зная постоянную Авогадро, можно найти абсолютное значение массы любого атома (молекулы) и оценить размеры атомов.
Массу атома (молекулы) m находят делением молярной массы М на постоянную Авагадро:
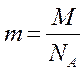 , г
, г
Молярный объем - это объем 1 моля вещества, выражается в л/моль.
Для определения мольного объема газов используется закон Авагадро: равные объемы всех газов при одинаковых условиях (температуре и давлении) содержат одинаковое число молекул.
Следствия закона Авагадро:
1) При одинаковых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
2) 1 моль любого газа при нормальных условиях занимает объем 22.4 л.
нормальные условия: н.у. 1атм= 101325 Па= 760 мм рт.ст. и 0 0С.
Для определения молярной (молекулярной) массы газообразных веществ можно использовать объединенный газовый закон (закон Менделеева-Клапейрона):
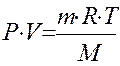 ,где
,где
Р - давление, Па;
V - объем, м3;
m - масса, г;
Т - температура, К;
М - молярная масса, г/моль;
R - универсальная газовая постоянная, Дж/моль∙К
 Для определения молекулярной массы газообразных веществ можно использовать также данные об относительной плотности газа.
Для определения молекулярной массы газообразных веществ можно использовать также данные об относительной плотности газа.
Относительная плотность одного газа по другому (D) - это отношение массы данного газа к массе того же объема другого газа, взятого при той же температуре и том же давлении.
Например, масса 1 л углекислого газа (СО2) равна 1,98 г, при тех же условиях масса 1 л водорода (Н2) равна 0,09 г. Следовательно, плотность углекислого газа по водороду составляет: 1,98: 0.09 =22
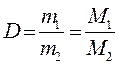 , где
, где
m1, m2 - массы 1 и 2-го газов, г;
М1, М2 - молярные (молекулярные) массы 1 и 2 -го газов.
Сложнее определить размер атомов. Размер атома можно определить только условно. Для кристаллических простых веществ за радиус атома принимают половину расстояния между центрами соседних атомов. Эту величину можно найти, зная плотность вещества и постоянную Авагадро. Если разделить объем занимаемый одним молем твердого простого вещества Vm (молярный объем) на постоянную Авагадро, то найдем объем V, приходящийся на один атом. Этот атом приблизительно можно рассматривать как шар, вписанный в куб объемом V, тогда радиус атома r выражается уравнением

Аналогично выражается радиус молекулы.
Для точного расчета размеров атомов необходимо знать их расположение в кристаллах твердых веществ. Установлено, что многие простые вещества имеют структуру аналогичную плотнейшей упаковке шаров. В такой упаковке на долю самих шаров приходится 74,05% от занимаемого объема.
Точное значение радиуса атома:
Радиусы атомов имеет значение порядка 100 пм.
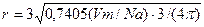
|
|
Дата добавления: 2014-01-06; Просмотров: 1114; Нарушение авторских прав?; Мы поможем в написании вашей работы!