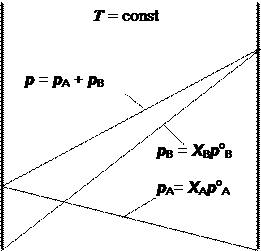КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общее давление пара над раствором равно сумме парциальных давлений компонентов
Двухкомпонентные растворы летучих жидкостей. Закон Рауля
В этом разделе мы остановимся на давлении пара компонентов бинарного (двухкомпонентного) раствора. Равновесное давление пара является мерой способности молекул переходить из жидкой фазы в паровую. Эта способность больше при высоких температурах и меньше - при пониженных. Она также снижается при уменьшении числа молекул жидкости, которые могут переходить в пар. Если в растворе половина молекул воды, а половина молекул - какого-либо нелетучего вещества, то давление пара воды над раствором должно быть вдвое меньше, чем над чистой водой. В общем случае если Х А - молярная доля компонента А в растворе и p Ао - давление пара чистого вещества А при данной температуре, то давление его пара над раствором p А определяется соотношением
p A = Х A po A.
Это же справедливо и для второго компонента раствора (В):
p В = Х В po В.
Эти уравнения являются математическим выражением закона Ф.М.Рауля (1882):
Давление пара компонента над раствором пропорционально его молярной доле в растворе.
Коэффициентом пропорциональности в этих уравнениях служит давление пара над чистым компонентом po А или po В.
На практике часто бывает удобнее пользоваться другой формой уравнения, связывающей параметры, относящиеся к обоим компонентам. Преобразуя выражение для компонента А, можно получить:
Х A = p A/ po A
или, так как Х A + Х В = 1,
1 - Х A = 1 - p A/ po A = Х B,
откуда
| po A - p A ¾¾¾¾¾ = Х B, po A |
что соответствует такой формулировке закона Рауля:
Относительное понижение давления пара растворителя над раствором численно равно молярной доле растворённого вещества.
Разность po A - p A называется понижением давления пара растворителя над раствором по сравнению с чистым растворителем, а выражение (po A - p A)/ po A - относительным понижением давления пара растворителя. Относительное понижение давления пара растворителя не зависит от природы растворителя и поэтому относится к так называемым коллигативным свойствам растворов(свойствам, которые зависят только от концентрации компонентов). Эта формулировка и соответствующее ей математическое выражение наиболее удобны при рассмотрении свойств растворов нелетучих веществ в летучих растворителях.
В соответствии с законом Дж. Дальтона (1801):
можно записать:
p = p A + p B
или
p = Х A po A + Х B po B
Поскольку Х A + Х B = 1, то
p = po A (1 - Х B) + po B Х B
и окончательно
p = po A + Х B (p B - p A) и p = po B + Х A (p A - p B),
откуда следует, что полное давление пара над раствором является линейной функцией молярной доли любого его компонента.
Закон Рауля справедлив во всей области концентраций только для идеальных растворов. Более того, существует даже такое определение идеальных растворов, как растворов, подчиняющихся закону Рауля. Объяснение этого заключается в том, что если силовые поля всех молекул веществ А и В в растворе одинаковы, то одинаковы и силы притяжения однородных и разнородных молекул (F А-А = F В-В = F А-В). При этом число молекул каждого компонента, переходящих в пар, уменьшается пропорционально понижению молярной доли вещества в растворе.
Закон Рауля может быть изображен графически в виде диаграммы в координатах “давление - состав” (рис. 7.1).
|
Рис. 7.1. Диаграмма “давление - состав” для идеального раствора
На таких диаграммах принято слева помещать тот компонент, который в чистом виде обладает меньшим давлением насыщенного пара. Например, допустим, что в данном случае это компонент А. Ось абсцисс (ось состава) на таких диаграммах ограниченна; на ней одновременно откладывается содержание обоих компонентов, обычно в молярных долях или в молярных процентах. Из точек, соответствующих чистым компонентам А и В, восстанавливаются две оси ординат – оси давлений. Каждая диаграмма строится при заданной постоянной температуре.
Точки, отвечающие давлениям насыщенного пара чистых компонентов (ро А и ро В), соединяются прямыми линиями с крайними точками оси состава и друг с другом. Две первые линии иллюстрируют повышение парциального давления пара каждого компонента с повышением его молярной доли в растворе в соответствии с законом Рауля. Третья линия является иллюстрацией закона Дальтона и одновременно линейности зависимости общего давления пара от молярной доли любого из компонентов.
|
|
Дата добавления: 2014-01-06; Просмотров: 2010; Нарушение авторских прав?; Мы поможем в написании вашей работы!