
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое начало термодинамики
|
|
|
|
Термодинамическая система находится в состоянии равновесия, если описывающие её макроскопические параметры не меняются с течением времени. Термодинамический процесс называется квазистатическим, если переход из одного состояние в другое происходит медленно, а каждое состояние системы можно считать равновесным.
О справедливости закона сохранения энергии можно утверждать, если сохранение энергии имеет место при переходе энергии из одной формы в другую. Именно это факт был доказан в первом начале термодинамики, впервые сформулированном Р.Клаузиусом (1822 – 1888), немецким физиком и математиком (рис.7.4), в 1854 году.
Он формулируется следующим образом: количество теплоты, полученное системой, идет на приращение ее внутренней энергии и на совершение системой работы против внешних сил:
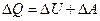 , (7.3.1)
, (7.3.1)
или в дифференциальной форме:
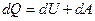 (7.3.2)
(7.3.2)

Рис.7.4. Рудольф Клаузиус.
Экспериментально, как уже отмечалось, связь между механической и тепловой энергией (механический эквивалент теплоты) была установлена в опытах Джоуля[2].
Первое начало термодинамики представляет собой закон сохранения механической и тепловой энергии при их взаимопревращениях. Отсюда стало понятно, что закон сохранения энергии должен носить всеобщий характер, сохраняясь при переходах энергии из одной формы в другую для всех видов энергий. Последующее развитие физики успешно подтвердило этот вывод экспериментально на атомном и ядерном уровнях, во всех взаимопревращениях элементарных частиц.
Одним из следствий первого начала термодинамики является утверждение, что количество теплоты, поглощаемое или выделяемое системой, зависит от пути перехода из одного состояния в другое. Рассмотрим действие первого начала термодинамики на некоторых изопроцессах.
|
|
|
В изотермическом процессе, когда температура постоянна (Т=const), изменения внутренней энергии не происходит (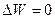 ) и, следовательно, передача некоторой системе тепла полностью расходуется на совершение работы
) и, следовательно, передача некоторой системе тепла полностью расходуется на совершение работы 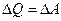 . Работа, совершаемая в этом процессе, вычисляется по РV - диаграмме как заштрихованная площадь под кривой (рис. 7.5):
. Работа, совершаемая в этом процессе, вычисляется по РV - диаграмме как заштрихованная площадь под кривой (рис. 7.5):
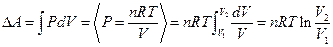 , (7.3.3)
, (7.3.3)
где 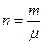 - число молей газа.
- число молей газа.
В изохорическом процессе, когда постоянен объем (V=const), механическая работа не совершается, так как 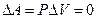 . Поэтому изменение внутренней энергии тела равно количеству переданной ему теплоты:
. Поэтому изменение внутренней энергии тела равно количеству переданной ему теплоты:
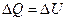 .
.
Отсюда следует, что при любых процессах, происходящих в замкнутой системе, когда 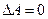 , внутренняя энергия остается неизменной.
, внутренняя энергия остается неизменной.
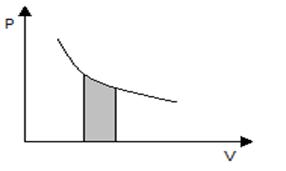
Рис.7.5. Вычисление работы, совершенной газом, в
изотермическом процессе.
В изобарическом процессе, когда постоянно давление (Р=const), тепло расходуется на изменение внутренней энергии (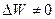 ), причем система совершает работу (
), причем система совершает работу (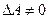 ):
):
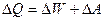 (7.3.4)
(7.3.4)
Пример 7.1. Установить связь между теплоемкостью при постоянном давлении ср и объеме сv. Если передача теплоты происходит при постоянном давлении, то удельную теплоемкость обозначают ср, если при постоянном объеме – сv.
В соотношении (7.3.4.) передача теплоты и изменение внутренней энергии системы при постоянном давлении и объеме описываются соответственно выражениями:
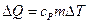 ,
, 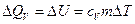 . (7.3.5)
. (7.3.5)
где 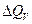 - передача тепла при постоянном объеме.
- передача тепла при постоянном объеме.
Для вычисления совершенной работы воспользуемся уравнением Клапейрона – Менделеева (6.4.7):
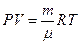 .
.
Из него получим выражение для изменения работы 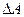 :
:
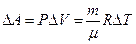 . (7.3.6)
. (7.3.6)
Подставляя (7.3.5) и (7.3.6) в (7.3.4) получим:
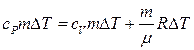 .
.
Откуда для вещества с молекулярной массой µ различие теплоемкостей при постоянном давлении и объеме составляет:
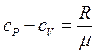 ,
,
А для одного моля газа это выражение имеет вид:
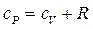 . (7.3.7)
. (7.3.7)
Адиабатический процесс происходит без изменения количества теплоты, поступающей в систему и отданной ею 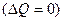 . Получим формулу, описывающую аналитически адиабатический процесс.
. Получим формулу, описывающую аналитически адиабатический процесс.
|
|
|
Для идеального газа это выражение вычисляется из первого начала термодинамики:
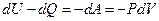 . (7.3.8)
. (7.3.8)
Учитывая, что при постоянном объеме 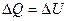 :
:
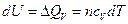 ,
,
уравнение (7.3.8) запишем в виде:
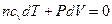 (7.3.9)
(7.3.9)
Дифференцируя соотношение:
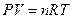 ,
,
получим
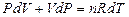 .
.
Выражая отсюда dT и подставляя в уравнение (7.3.9), получаем:
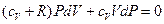 (7.3.10)
(7.3.10)
Учитывая (7.3.7), уравнение (7.3.10) принимает вид:
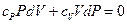 . (7.3.11)
. (7.3.11)
Обозначим 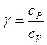 .
.
Уравнение (7.3.11) можем записать в виде:
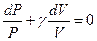 .
.
Откуда, интегрируя предыдущее выражение, получим:
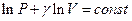 . (7.3.9)
. (7.3.9)
Таким образом, при адиабатическом расширении (сжатии) идеального газа выполняется соотношение:
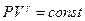 . (7.3.10)
. (7.3.10)
Адиабатический процесс представлен на (рис.7.6). Примером такого процесса может служить быстрое накачивание насосом футбольного мяча. Если скорость движения поршня велика, то вся совершенная работа переходит во внутреннюю энергию газа в камере мяча. Нагреванием насоса можно пренебречь.
Пример.7.2. Рассчитать отношение теплоемкостей при постоянном давлении и объеме для одноатомного идеального газа.
Рассмотрим процесс при постоянном объеме: 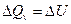 . Внутренняя энергия n молей одноатомного идеального газа – это суммарная кинетическая энергия его молекул, которая составляет:
. Внутренняя энергия n молей одноатомного идеального газа – это суммарная кинетическая энергия его молекул, которая составляет:
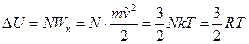 ,
,
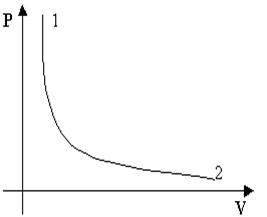
Рис.7.6. Адиабатический процесс.
а для потока тепла при постоянном объеме, справедливо соотношение (7.3.5):
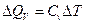 .
.
Откуда, используя соотношение (7.3.7), для идеального одноатомного газа теплоемкость при постоянном объеме, составляет:
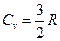 ,
,
а при постоянном давлении:
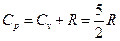
Коэффициент 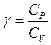 в выражении для адиабатического процесса
в выражении для адиабатического процесса 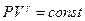 для одноатомного идеального газа составляет:
для одноатомного идеального газа составляет:
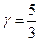
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!