
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорія хімічної будови органічних сполук Бутлерова
|
|
|
|
План
Лекція 13. Вступ до органічної хімії.
1. Значення органічної хімії та її роль у виробництві продовольчих і непродовольчих товарів.
2. Теорія хімічної будови органічних сполук Бутлерова.
3. Явище ізомерії.
Органічна хімія почала служити людині ще в глибокій давнині, коли тисячолітній досвід заміняв знання і дозволяв перетворювати продукти бажаним шляхом. Людині, наприклад, давно відомі речовини органічного походження – цукри, які входять до складу рослинних соків, рослинні і тваринні масла та жири, фарбуючі, пахучі та лікуючі речовини. Поступово люди навчились шляхом переробки цих речовин одержувати різноманітні цінні продукти. Так, з рослинних соків вже в давнину вміли добувати вино, а з нього – оцет.
Таким чином, органічні речовини вже давно мали для людей велике практичне значення.В теперішній час практично немає ні однієї галузі народного господарства, не зв’язаної так чи інакше з органічною хімією. Життя сучасної людини неможливе без органічних речовин.
Важливе значення за останні десятиріччя отримали високомолекулярні органічні речовини. Промисловість зараз виробляє велику кількість синтетичних смол, а на їх основі – різноманітні пластичні маси.
Надзвичайне значення має виробництво синтетичного каучуку, який в останній час практично повністю заміняє натуральний каучук. Важливою галуззю хімічної промисловості є синтетичне одержання органічних фарбуючих речовин. З розвитком хімії були розроблені синтези барвників, які раніше отримували тільки з дорогих природних продуктів. Причому, у багатьох випадках синтетичні барвники за властивостями переважають природні.
Багато продуктів промисловості органічної хімії відіграють важливу роль в сільському господарстві. Так, виробництво гербіцидів – речовин, які знищують бур’яни, значно скорочує затрати праці по догляду за посівами сільськогосподарських культур. Деякі органічні речовини застосовують як стимулятори росту сільськогосподарських культур та плодових рослин.
|
|
|
Велика кількість синтетичних органічних речовин широко використовуються як добавки до кормів. Їх застосування поповнює білкову недостатність кормів, прискорює ріст тварин і скорочує затрати кормів на одиницю продукції.
Нафтохімічна та нафтопереробна промисловості є найважливішими галузями хімічного виробництва і дають близько половини всіх одержуваних органічних сполук. З нафти шляхом її переробки одержують різні види палива, мастильні матеріали та інші цінні продукти.
Органічні речовини відіграють величезне значення у виробництві продовольчих та непродовольчих товарів. Так, наприклад, високомолекулярні сполуки (пластмаси) застосовують у виробництві меблів, для виготовлення різних предметів домашнього вжитку, при виробництві електротоварів, непромокаючих тканин, плащів, накидок, оздоблювальних матеріалів тощо.
Органічна хімія відіграє важливу роль у виробництві текстильних товарів.
Наприклад, бавовняне волокно складається з целюлози, шерстяні та натуральні шовкові волокна – з білкових речовин. Крім того, розроблені методи одержання різних видів штучних і синтетичних волокон. Як приклад штучних волокон можна назвати різні види целюлозного шовку (віскозний, ацетатний та ін.); синтетичні волокна – капрон (перлон), анід (найлон), лавсан (терилен) та ін.
Серед промислових товарів великим попитом користуються різні види
гумового взуття, яке виготовляють в наш час винятково з синтетичного каучуку.
Виробництво продовольчих товарів в значній мірі пов’язане з використанням різних органічних речовин.
|
|
|
Сировина харчової промисловості має рослинне і тваринне походження і
містить різноманітні органічні речовини, в тому числі жири, білки та вуглеводи.
Успіхи органічної хімії в отриманні харчових продуктів дозволили розробити нормальний раціон харчування людини. Особливе значення в цьому плані має відкриття та вивчення вітамінів – органічних фізіологічно активних речовин, відсутність яких в їжі людини призводить до порушення нормальних функцій організму. Велику роль зіграло також відкриття та вивчення ферментів – біологічних каталізаторів, які спричиняють процеси бродіння, розщеплення жирів, білків тощо.
У світі розвитку хімічної промисловості, органічному синтезу, приділяється особлива увага. Метал, дерево, натуральні волокна та інші матеріали поступово заміняються синтетичними матеріалами.
Велику роль у розвитку органічної хімії відіграла теорія хімічної будови органічних сполук, засновником якої був великий російський хімік - органік О.М. Бутлеров. Розглянемо основні положення цієї теорії.
До робіт О.М.Бутлерова не приділялося достатньо уваги уявленням про розміщення атомів у молекулах, хоча атомно-молекулярне вчення вже утвердилося в хімії. О.М. Бутлеров ввів поняття про хімічну будову - чітко визначений порядок розміщення атомів у молекулі. В основу теорії будови було покладено валентність елементів - важливу властивість атомів, яка характеризує їхню здатність до утворення хімічних зв'язків. Згідно з теорією Бутлерова в молекулах речовин атоми сполучені один з одним у певній послідовності відповідно до їхньої валентності, тобто молекули мають точну хімічну будову.
О.М. Бутлеров припускав, що вуглець в органічних сполуках чотирьохвалентний, тобто може бути сполучений з чотирма іншими одновалентними атомами. При цьому атоми вуглецю можуть сполучатися один з одним і з атомами різних елементів. Дослідження будови атомів і природи хімічного зв'язку підтвердили ці припущення. Згідно з сучасними електронними уявленнями хімічний ковалентний зв'язок виникає за рахунок неспарених електронів атома. Так, атом вуглецю при утворенні органічної сполуки переходить з основного електронного стану в збуджений.
|
|
|
Чотири орбіталі атома вуглецю, що містять неспарені електрони, дають змогу атому утворити чотири ковалентних зв'язки, тобто бути чотирьохвалентними у сполуках.
Хімічну будову молекул органічних речовин записують за допомогою структурних формул, у яких зазначають усі їх хімічні зв'язки між атомами, зв'язок зображають рискою. Згідно з електронною теорією одна риска в структурних формулах означає електронну пару, що сполучає атоми.
Так, структурні формули органічних сполук етану С2Н6, етилену С2Н4 і пропану С3Н8 мають такий вигляд:

Структурні формули сполук можна зображувати у спрощеній формі, вказуючи тільки зв'язки між атомами вуглецю. Наприклад, формули етану, етилену і пропану можна записати так:
СН3 - СН3; СН2 = СН2; СН3 - СН2 - СН3.
Такий запис широко використовується в органічній хімії.
До створення теорії хімічної будови вважалося, що властивості сполук визначаються тільки їх складом. Це багато в чому правильне положення не могло пояснити явища ізомерії - прояву різних властивостей речовинами, що мають однаковий склад. Такі речовини дістали назву ізомерів. Наприклад, складу С2Н6О відповідають дві органічні сполуки - етиловий спирт (етанол) і диметиловий ефір, які відрізняються за хімічними і фізичними властивостями. Наприклад, етанол реагує з натрієм (при цьому виділяється водень), має температуру кипіння 78°С; диметиловий ефір з натрієм не реагує, кипить при температурі - 24°С.
О.М. Бутлеров показав, що властивості речовин залежать від хімічної будови молекул. Отже, теорія О.М. Бутлерова пояснює явище ізомерії різним розміщенням атомів у молекулах. У прикладі з речовинами складу С2Н6О відмінність у їхніх властивостях зумовлено тим, що етиловий спирт і диметиловий ефір мають різну хімічну будову:

На підставі своєї теорії О.М. Бутлеров висловив припущення про існування деяких речовин. Так, він передбачив, що складу С4Н10 мусять відповідати дві речовини: нормальний бутан і ізобутан. Дійсно, ним був синтезований ізобутан, що підтвердило правильність теоретичних припущень.
|
|
|
Атоми в молекулах впливають один на одного, при цьому найбільш сильний взаємний вплив виявляється у сполучених безпосередньо атомів. Наприклад, до складу молекули етилового спирту входять шість атомів водню, проте лише один з них має досить високу рухливість і може бути заміщений на метал:
2C2Н5ОН+ 2Nа ®2С2Н5ОNа + Н2
Рухливість одного атома водню пояснюється впливом сполученого з ним атома кисню. Цей атом кисню впливає і на найближчі атоми вуглецю. Наприклад, якщо окислювати дану речовину, то зміни відбуваються лише з атомом вуглецю, який сполучений з киснем:
С2Н5ОН + [О] ® СН3СОН+ Н2О
Основні положення теорії хімічної будови полягають ось у чому:
1) атоми в молекулах сполучені у певній послідовності, тобто молекули мають певну хімічну будову;
2) будова молекул зумовлена електронною будовою атомів, що входять до складу молекул;
3) властивості речовини визначаються хімічною будовою молекул та їхнім складом;
4) атоми в молекулах чинять взаємний вплив один на одного, тобто реакційна здатність атомів залежить від того, з якими атомами вони сполучені в молекулі.
Вуглеводні - це сполуки, які складаються із вуглецю і водню. Загальна формула  .
.

Хімічні з зв'язки діляться на типи по принципу їх електронної будови. Гетерополярний (електровалентний, іонний) зв'язок. При утворенні гетерополярного зв'язку відбувається передача електрону від одного атому до другого, перший перетворюється у позитивно заряджений іон (катіон), другий - в негативно заряджений іон (аніон). Схематично це можна відобразити таким чином:
 |

Іонний зв'язок володіє рядом особливостей: значною полярністю, немає визначеного напрямку у просторі, а молекули сполук с таким зв'язком відрізняються здібністю до дисоціації на іони і сольватацією останніх високополярних розчинниках; високою швидкістю проходження реакцій з їх участю; розчинність у полярних розчинниках; електропровідністю розчинам; високими температурами плавлення та кипіння.
Ковалентний (гомеополярний) зв'язок. Більшість молекул органічних сполук, збудовані за допомогою ковалентного зв'язку, які виникають за утворенням одної чи декілька електронних пар, які стають загальними для взаємодіючих атомів:

Ковалентний зв'язок утворюють атоми володіючи рівною електронегативністю. З'являється єдина електронна хмарка, густина якої між ядрами особливо велика, що забезпечує стійкість молекули.
Ковалентний зв'язок може бути охарактеризований довжиною зв'язку, направленістю у просторі, енергією утворення, полярністю, поляризуємостю. Одною з особливістю ковалентного зв'язку є її визначений просторовий напрямок, який може бути охарактерезований за допомогою валентного кута. Валентний кут між зв'язками атома вуглецю залежить від типа гібридизації, від атома, з яким він пов'язаний. Визначення валентних кутів виробляють рентгенографічним, електронографічним та спектральними методами.
Водневий зв'язок. Зв'язок виникаючий між електронегативними атомами, який містить одну вільну електронну пару (О, N, S) та ковалентну зв'язаним атомам водню, який володіє підвищеною рухомістю називається водневий зв'язок.
Гібридизація орбіталей. Не в збудженому атомі вуглецю ( ) на першому електронному рівні знаходяться два спарених електрони (
) на першому електронному рівні знаходяться два спарених електрони ( ), а на другому електронному рівні - два спарених електрона на 2s - орбіталі (2s2) і по одному неспареному електронах на двох р-орбіталях (
), а на другому електронному рівні - два спарених електрона на 2s - орбіталі (2s2) і по одному неспареному електронах на двох р-орбіталях ( і
і  ), а одна р-орбіталь залишається вільною (
), а одна р-орбіталь залишається вільною ( ). У такому стані вуглець повинен бути двух- валентним. Однак добре відомо, що у подавленій більшості сполук вуглець чотирьохвалентний і що усі чотири зв'язки у такого роду симетричних структурах (СХ4) однакові.
). У такому стані вуглець повинен бути двух- валентним. Однак добре відомо, що у подавленій більшості сполук вуглець чотирьохвалентний і що усі чотири зв'язки у такого роду симетричних структурах (СХ4) однакові.
Суть цього поняття заключається у тому, що близькі по енергії ті маючі загальний елемент симетрії молекулярні оробіталі можуть взаємодіяти між собою, утворюючи так називаємі гібридні орбіталі з більш низькою енергією.
Так, при взаємодії s-орбіталі з  орбіталью утворюються sp-гібридизовані орбіталі, наприклад, у атомів вуглецю ацетилену та ориєнтировані по осі c. Такий тип гібридизації називається sp-гібридизація.
орбіталью утворюються sp-гібридизовані орбіталі, наприклад, у атомів вуглецю ацетилену та ориєнтировані по осі c. Такий тип гібридизації називається sp-гібридизація.
Електронегативність атому вуглецю, дорівнює 2,5; характеризує атоми вуглецю у степені гібридизації sp3.
Фізична природа ковалентного зв'язку. Атомні орбіталі. Зоммерфільд ввів друге квантове число i - азимутальне квантове число та предполагає, що електрони можуть знаходитись не тільки на кругових, но і на еліпсових орбіталях. При головному квантовому числі n друге квантове число i могло прийняти значення від 0 до n-1. Кожному значенню i відповідала якась форма електронної орбіталі, яка позначалась як s (при i = 0), р (при i = 1), d (при i = 2) і т. п.
Хвильове рівняння Шредингера. Якщо позначити рішення хвильового рівняння Шредингера через y (c, y, z) та назвати його хвильову функцією, то y2 (c, y, z) виходить пропорціональним р (c, y, z). Підібрав відповідний постійний числовий множник, можна получити
y2 (c, y, z) = р (c, y, z),
при цьому хвильова функція залишиться визначенням рівняння Шредингера.
При рішенні хвильового рівняння Шредингера y є у де яких областях позитивна, а у де яких негативна. Оскільки імовірність має суть лише у межах позитивного значення від 0 до 1, то у загалі використовують величину y2 , а не просто y, коли хочуть пов'язати хвильову функцію з поняттям густини можливості.
Різні речовини, що мають однакову молекулярну формулу, але відмінні за будовою молекул є ізомерами
3. Явище ізомерії.
Існування ізомерів називають явищем ізомерії
Пояснення ізомерії можливе лише на основі теорії Бутлерова
Загальною закономірністю є збільшення кількості ізомерів зі збільшенням кількості атомів у молекулах. Так, наприклад, для гомологічного ряду насичених вуглеводнів кількість ізомерів відповідно дорівнює: C3H8 -1; C4H10 - 2; C5H12 - 3; C6H14 - 5; C7H16 - 9.
Типи ізомерії
Структурна ізомерія визначається відмінністю у будові ланцюгів Карбону або відмінністю у положенні функціональних груп або кратних зв'язків
• • ізомерія вуглецевого скелету
Насичений вуглеводень бутан C4H10 утворює два ізомери, які відрізняються порядком з'єднання атомів Карбону. Ароматичні вуглеводні антрацен і фенантрен мають однакову молекулярну формулу С14H10, але відрізняються порядком з'єднання атомів Карбону, тобто є ізомерами.

В залежності від кількості атомів Карбону, які зв'язані з даним атомом Карбону розрізняють:
первинний атом Карбону має хімічний зв'язок лише з одним атомом Карбону;
вторинний атом Карбону має хімічний зв'язок з двома атомами Карбону;
третинний атом Карбону має хімічний зв'язок з трьома атомами Карбону;
четвертинний атом Карбону має хімічний зв'язок з чотирма атомами Карбону.

• • ізомерія положення функціональних груп або кратних зв'язків


• • ізомерія взаємного положення функціональних груп або кратних зв'язків

• • метаметрія
Метаметрія є ізомерією, що визначається різним розташуванням вуглеводневих радикалів відносно функціональних груп:

Просторова ізомерія визначається відмінністю розташування атомів і функціональних груп у просторі
• • геометрична ізомерія
Якщо два атоми Карбону утворюють подвійний зв'язок, то валентні орбіталі кожного з них знаходяться у стані sp2-гібридизації. Кожний з атомів Карбону утворює по три s–зв’язки, які знаходятся у одній площині і направлені до вершин рівностороннього трикутника. p–Зв’язок між атомами Карбону розташований у площині, що є перпендикулярною до площини, в якій розташовані s–зв’язки. Тобто s–зв’язки і p–зв’язок розташовані у взаємно перпендикулярних площинах.
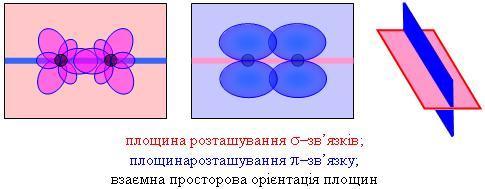
Розглянута будова молекул з подвійним зв’язком обумовлює так звану цис- і транс-ізомерію. До цис-ізомерів відносять такі, що мають однакові замісники по одну сторону від площини, в якій розташований p–зв’язок. До транс-ізомерів відносять такі, що мають однакові замісники по різні сторони від площини, в якій розташований p–зв’язок.

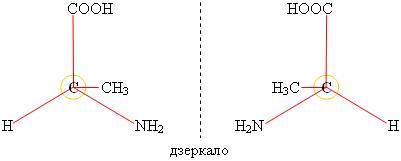
• • оптична ізомерія
Якщо атом Карбону утворює чотири хімічні зв’язки з різними замісниками, то виникає явище так званої оптичної ізомерії. Оптичні ізомери відносяться як дзеркальні відображення. Наприклад, сполука аланін* (a-амінопропіонова кислота) утворює два оптичні ізомери:
Динамічна ізомерія (таутомерія) визначається співіснуванням різних ізомерів, що при звичайних умовах можуть переходити один у другий
Глюкоза може утворювати одну лінійну і дві циклічні форми, що співіснують при звичайних умовах:

a-Глюкоза і b-глюкоза відрізняються положенням гідроксогрупи біля атома Карбону С1.
Література
Основна література.
41. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607 с.
42. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
43. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
44. Логинов Н.Я. Аналитическая химия. /Логинов Н.Я., Воскресенський А.Г., Солодкин, И.С./ – М.: “Просвещение”, 1975. – 477с.
Додаткова література.
45. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
46. Омелян В.І, Шешеня С.К. Навчальний комплекс з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. загальні основи аналітичної хімії. Для віртуально-тренінгової технології самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”, 7.00503.02 “Товарознавство та експертиза в митній справі”. – Полтава: РВВ ПУСКУ, 2002. – 179.
47. Омелян В.І. Опорний конспект лекцій з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. Загальні основи аналітичної хімії для студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі” та МІПК. – Полтава: РВВ ПУСКУ, 2003. – 60.
48. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3801; Нарушение авторских прав?; Мы поможем в написании вашей работы!