
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентные кристаллы и ковалентная связь
|
|
|
|
Классификация кристаллов по типам связи.
Ориентационная поляризация.
Молекулярная поляризация.
Электронная поляризации.
Виды поляризации
Все материалы содержат ионы, окруженные электронным облаками е – малоинерционные системы, они очень быстро реагируют на изменение поля, могут реагировать на поле оптического диапазона частот.
Приложенное электрическое поле воздействует на ионные решетки и растягивает связи между атомами (решетки N2Cl).
Наложение электрического поля в этом случае приводит к маленьким изменениям ионной связи. При этом увеличивается дипольный момент решетки.
Наблюдается, когда молекулы, имеющие постоянный или индукционный момент, ориентируются в направлении электрического поля. В слабом электрическом поле не все молекулы выстраиваются сразу в одном направлении. Согласно статистике Больцмана при термодинамическом равновесии число молекул с данной энергией Е пропорциональна:
Exp[-E/KT]. Если бы все молекулы выстраивались в одном направлении в эл.поле, то энергия была бы min при V отличной от нуля температуре будут J и др направления ориентации.
Средний дополнительный момент будет обратно пропорционален абсолютной температуре.
Кристаллическая структура и свойства твёрдого тела в значительной части определяется характером связи между частицами.
Ионные кристаллы, и связь атомов в кристалле за счёт ионной связи.
Атомы, стоящие в периодической системе вблизи инертных газов, могут легко принимать их конфигурацию, отдавая или принимая электроны. У атомов щелочных металлов за инертными газами валентный электрон движется вне заполненной оболочки, слабо связан с ядром, энергия отрыва достаточно мала (?? электрон/вольт). Поэтому эти галогены обладают высоким сродством к дополнительным электронам (прим. 3 эл/вольт)(галогенам не хватает электронов). Связь между сильными металлами и галогенами осуществляется следующим образом: происходит перезарядка обоих атомов, электрон от атома металла переходит к атому галогена. При этом атом металла превращается в положительно заряженный ион – катион. Эти ионы взаимодействуют по закону Кулона, как два разноимённых иона. Такую связь называют ионной или??терополярной, а кристаллы – ионные.
|
|
|
Энергия притяжения ионов, отстоящих друг от друга на расстоянии r составляет:

ε0 – диэлектрическая проницаемость вакуума;
e – заряд иона.
При достаточном сближении ионов между ними возникает отталкивание, энергия которого равна:

B – константа;
n – постоянная величина.
В итоге результирующая энергия взаимодействия

Графически эта зависимость выглядит:
 |
Равновесное расстояние между частицами – минимум функции – получим, приравняв производную функции U к нулю, выразив r, тогда:
 (*)
(*)
Из соотношения (*) найдём значение B и полученное значение для B подставим в уравнение для полной энергии. Получим выражение для энергии связи атомов в таком кристалле:
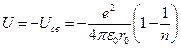
Энергия решётки, построенной из N пар ионов, будет равна:

где А – постоянная Моделунга.
А учитывает тот факт, что взаимодействие данного иона должно происходить не только с ближайшим отрицательно заряженным соседом, но и с другими соседями. В ионных кристаллах не существует отдельных молекул и каждый положительно заряженный ион окружён соответствующим числом отрицательных ионов, и наоборот каждый отрицательный ион имеет такое же число положительно заряженных ионов.
Число z ближайших соседей, окружающих ион, называется координационным числом. Для ионных решёток z зависит от отношения радиуса катиона к радиусу аниона:
|
|
|
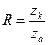
Например при R>0.73 – кадмий, селен – z=8
NaCl – z=6 (CL окружён 6 ионами Na)
R<0.41 – LiF – z=4
Ионная связь сильная, энергия – от 100 до 1000 кДж/моль
Поэтому ионные кристаллы обладают значительной твёрдостью и прочностью, имеют высокие точки плавления, высокую теплоту сублимации (твёрдое тело → в пар)
Электропроводность таких материалов имеет ионную природу и сильно зависит от температуры. Многие ионные кристаллы прозрачны в широком диапазоне длин волн.
Взаимодействие двух атомов водорода (состоят из ядра и одного электрона, который вращается около ядра)

В следствие того, что плотность электронного облака, описывающего состояние электрона в атоме, уменьшается быстро с удалением от ядра, при значительном расстоянии между А и В вероятность обнаружить электрон 1 вблизи ядра В очень мала, а электрон 2 вблизи А – также мала. Электрон – это ещё и волна.
Атомы А и В изолированы. Энергия системы, состоящей из двух атомов, принять равной 2Е0, где Е0 – энергия изолированного атома. По мере сближения атомов вероятность перехода электрона к чужим ядрам увеличивается.
При ε ≈ 0.2 нм (10-9) наступает заметное перекрытие электронных облаков этих атомов, и частота перехода достигает величины 1014 за 1 сек. При дальнейшем сближении степень перекрытия облаков растёт, и частота обмена атомов электронами увеличивается настолько, что теряет смысл говорить о принадлежности электрона атому (1-а; 2-б)
Это соответствует возникновению нового состояния, не свойственного системе: электроны в этом состоянии принадлежат одновременно двум ядрам (электроны обобществлены). Это обобществление сопровождается перераспределением электронной плотности и изменением системы по уравнению с энергией 2Е0 изолированных атомов. Перераспределение состоит в стягивании электронных облаков в пространство между ядрами. Появление состояния с повышенной плотностью электронного облака заполняющего межъядерное пространство всегда вызывает уменьшение энергии системы и приводит к возникновению сил притяжения. Электронное облако повышенной плотности, которое образуется в межъядерном пространстве обобщенной парой парой электронов, как бы стягивает ядра, стремясь максимально приблизить эти ядра. Энергию связи, которая возникает в результате попарного обобщения электронов, называют обменной энергией. В действительности эта энергия является электростатической энергией взаимодействия электронного облака повышенной плотности, формирующегося между атомами с ядрами этих атомов.
|
|
|
Характерными особенностями связи являются: насыщаемость и направленность. Насыщаемость – каждый атом способен образовать ковалентную связь с определённым количеством соседей. Этим и определяется координационное число решётки, в которой действует такая связь. Ковалентная связь образуется в том направлении, в котором расположена большая часть электронного облака, соответствующего валентным электронам, при этом осуществляется максимальное перекрытие облаков связующих электронов: это и означает, что ковалентная связь имеет направленный характер, который играет большую роль в определении пространственного положения атомов в решётке. Такую решётку и ковалентную связь имеют кремний и германий – у них 4 валентных электрона, которые они обобществляют (спаривают) с электронами 4 соседних атомов. Энергия ковалентной связи высока ≈ 100 кДж/моль, ковалентные кристаллы обладают высокой прочностью, твёрдостью, высокие точки плавления и сублимации. Алмаз существует благодаря ковалентной связи. При температуре ≈0 в электронном отношении материалы являются диэлектриками. Многие из этих материалов прозрачны в длинноволновой части спектра.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 643; Нарушение авторских прав?; Мы поможем в написании вашей работы!