
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальные данные по теплоемкости
двухатомных газов: вымораживание степеней свободы
В соответствии с законом равнораспределения теплоемкость моля двухатомного газа должна быть равна 7 R / 2. Однако эксперимент показал, что столь большой теплоемкостью двухатомные газы не обладают. Более того, ее значение зависит от температуры. Эту зависимость теплоемкости можно охарактеризовать следующим образом (рис. 4.3).
При высоких температурах теплоемкость, хотя и не достигает теоретического значения из-за диссоциации молекул, но стремится к нему. При понижении температуры теплоемкость падает и стремится к значению 5 R /2. Это значение достигается при комнатной температуре. При дальнейшем понижении температуры теплоемкость не меняется, пока не начинает сказываться межмолекулярное взаимодействие.

|
| рис. 4.3. |
Однако для водорода эксперимент обнаружил, что при температурах ниже 80 K теплоемкость становится близкой к 3 R /2, то есть водород при очень низких температурах имеет теплоемкость такую же, как и одноатомный газ.
Эти результаты можно объяснить, если предположить, что колебательное и вращательное движения молекул водорода по какой-то причине оказываются замороженными. Подобные эффекты наблюдаются и у многоатомных газов. Эти эффекты получают свое объяснение только при использовании представлений квантовой механики. Оказалось, что энергия атомов и молекул может принимать только дискретный ряд значений.
Колебательное движение с малой амплитудой можно считать гармоническим. Энергия линейного гармонического осциллятора, согласно законам квантовой механики принимает дискретный ряд значений:
 (4.24)
(4.24)
Здесь w – классическая частота колебаний осциллятора,  – постоянная Планка. Каждому значению энергии (4.24) отвечает одно квантовое состояние. При переходе системы с одного уровня энергии на другой излучается или поглощается свет с энергией
– постоянная Планка. Каждому значению энергии (4.24) отвечает одно квантовое состояние. При переходе системы с одного уровня энергии на другой излучается или поглощается свет с энергией  (переходы возможны только между соседними уровнями).
(переходы возможны только между соседними уровнями).
Статистическая сумма осциллятора вычисляется как сумма бесконечной убывающей геометрической прогрессии:
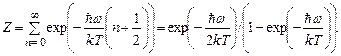 (4.25)
(4.25)
Отсюда
 (4.26)
(4.26)
и для средней энергии осциллятора получается выражение
 (4.27)
(4.27)
Вклад в теплоемкость колебательного движения равен
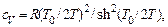 (4.28)
(4.28)
где  – так называемая характеристическая температура.
– так называемая характеристическая температура.
Зависимость cV от T показана на рис. 4.4. При высоких температурах, когда энергия теплового движения молекулы (величина порядка kT) велика по сравнению с расстоянием между уровнями энергии, формулы (4.27) и (4.28) дают классическое приближение:
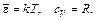

|
| Рис. 4.4 |
При низких температурах энергия теплового движения молекулы недостаточна для возбуждения ее колебательного движения и
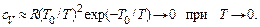
Характеристическая температура T 0 для водорода равна 6100 K, для кислорода 2250 K, для азота 3340 K, у HCl 4200 K и т. д. Комнатные температуры на порядок ниже характеристических, поэтому при комнатных температурах колебательное движение молекул двухатомных газов заморожено. Изменение с температурой вклада в теплоемкость колебательного движения молекул согласуется с результатами измерений.
Аналогичное объяснение имеет температурная зависимость составляющей теплоемкости, связанной с вращательным движением молекул. Энергия вращения тоже меняется по законам квантовой механики дискретно как:
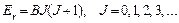 (4.29)
(4.29)
где  - вращательная постоянная,
- вращательная постоянная, 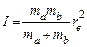 есть момент инерции,
есть момент инерции,  - равновесное межъядерное расстояние. Каждому значению J соответствует 2 J + 1 состояний.
- равновесное межъядерное расстояние. Каждому значению J соответствует 2 J + 1 состояний.
Однако характеристические температуры в этом случае значительно ниже комнатной температуры. Для водорода 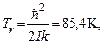 для кислорода 2,07 K, для азота 2,85 K, для HCl 15,1 K. Поэтому при комнатной температуре вращательное движение молекул полностью возбуждено и вклад его в теплоемкость полностью определяется в соответствии с законом равнораспределения. Только водород остается газообразным при температурах ниже характеристической температуры. Для него вымораживание вращательного движения молекул наблюдается экспериментально.
для кислорода 2,07 K, для азота 2,85 K, для HCl 15,1 K. Поэтому при комнатной температуре вращательное движение молекул полностью возбуждено и вклад его в теплоемкость полностью определяется в соответствии с законом равнораспределения. Только водород остается газообразным при температурах ниже характеристической температуры. Для него вымораживание вращательного движения молекул наблюдается экспериментально.
Глава 5
|
|
Дата добавления: 2014-01-07; Просмотров: 605; Нарушение авторских прав?; Мы поможем в написании вашей работы!