
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 14. Свойства растворов неэлектролитов
Растворимость газа в чистом растворителе больше, чем в растворе электролита.

где No – молярная доля газа в чистом растворителе (например, О2 в чистой воде);
N – молярная доля газа в растворе электролита (например, О2 в водном растворе NaCl);
с – концентрация электролита в растворе (например, NaCl в воде);
К – коэффициент пропорциональности.
Из уравнения видно, что чем больше концентрация электролита в растворе (с), тем меньше газа растворяется в данном растворе (то есть меньше N).
1. Понижение давления насыщенного пара растворителя над раствором.
2. Законы Рауля.
3. Осмос и осмотическое давление растворов неэлектролитов. Биологическое значение осмоса и осмотического давления.
1. Понижение давления насыщенного пара растворителя над раствором
Растворы имеют ряд свойств, которые при данной температуре зависят только от числа частиц растворенного вещества. Эти свойства называют коллигативными: чем больше частиц в растворе, тем сильнее выражены коллигативные свойства.
К коллигативным свойствам относятся:
1) понижение давления насыщенного пара растворителя над раствором;
2) повышение температуры кипения раствора;
3) понижение температуры замерзания (кристаллизации) раствора;
4) осмотическое давление.
Рассмотрим эти свойства в отдельности.
Жидкость обладает свойством испаряться, отрываясь с поверхности жидкости, и если сосуд открытый (рис. 18), то частички пара будут улетать, пока вся жидкость не испарится.
Если сосуд закрыть крышкой (рис. 19), то молекулы пара, ударяясь о поверхность жидкости, могут поглотиться жидкостью, снова переходя в жидкое состояние. И наступит момент, когда установится равновесие процессов испарения жидкости () и конденсации пара (¯). Пар, находящийся в равновесии со своей жидкостью, называется насыщенным паром, а давление этого пара называется давлением насыщенного пара. Давление насыщенного пара постоянно при данной температуре и не зависит от количества взятой жидкости и количества пара над жидкостью.
|
|
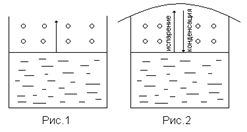
До сих пор мы рассматривали испарение чистых растворителей, например, чистой воды. Если растворим в воде нелетучее вещество (например, сахар), то получим раствор. При этом испаряться будет только вода, превращаясь в пар, а нелетучий сахар не будет испаряться. Давление насыщенного пара растворителя (воды) над водным раствором сахара (р) всегда будет меньше, чем давление насыщенного пара (ро) растворителя (вода) над чистым растворителем (чистой водой), то есть р< ро.
2. Законы Рауля.
Французский ученый Рауль в 1887 г. сформулировал закон:
Относительное понижение давления насыщенного пара растворителя над раствором (по сравнению с чистым растворителем) равно молярной доле растворенного вещества, то есть:
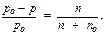
где n - число молей растворенного вещества (сахара);
n о – число молей растворителя (воды).
Так как закон Рауля строго применяется только для сильно разбавленных растворов нелетучих неэлектролитов, в которых n<<nо, поэтому значением n в знаменателе можно пренебречь и тогда получаем:
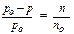 - закон Рауля для сильно разбавленных растворов нелетучих неэлектролитов.
- закон Рауля для сильно разбавленных растворов нелетучих неэлектролитов.
Вопрос повышения температуры кипения разбавленных растворов неэлектролитов тесно связан с давлением насыщенного пара над жидкостью. Любая жидкость (чистый растворитель или раствор) закипает при той температуре, при которой давление насыщенного пара над этой жидкостью становится равным внешнему (атмосферному) давлению. Так, чистая вода кипит при 100°С, так как при этой температуре давление водяного пара равно внешнему давлению (одной атмосфере или 1,013×105 Па).
Растворы (сахар в воде) кипят при более высокой температуре, чем чистая вода, так как давление насыщенного водяного пара над раствором меньше, чем над чистой водой (р < ро по закону Рауля), поэтому раствор надо дополнительно нагреть, чтобы увеличить давление насыщенного пара до атмосферного давления.
Кривая АВ на приведенном рисунке 20 характеризует зависимость от температуры давления насыщенного водяного пара над чистой водой, а кривая СД – над раствором. Чистая вода (растворитель) кипит при 100°С. Раствор же при 100°С будет иметь меньшее давление на величину Dр. Давление пара над раствором достигнет 1 атмосферы при более высокой температуре (t1) – это и будет температура кипения раствора. Разность между температурой кипения раствора (t1) и температурой кипения воды (100°С) называется повышением температуры кипения раствора Dtкип..

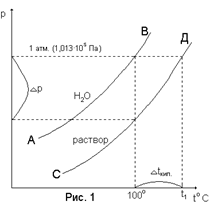
Рисунок 20. Зависимость давления насыщенного водяного пара от температуры
Повышение температуры кипения раствора прямо пропорционально моляльной концентрации (сm) раствора.
Dtкип. = Е× сm – это следствие из закона Рауля для кипения раствора.
Е – эбулиоскопическая постоянная (эбулио – это кипение), она зависти от природы растворителя (вода, бензол и др.) и приводится в справочниках (например, для воды Е = 0,52°).
Любая жидкость (чистый растворитель или раствор) замерзает при той температуре, при которой давление насыщенного пара над жидкостью (например, над жидкой водой) будет равно давлению пара над твердой фазой (например, твердой водой, то есть льдом), то есть установится равновесие между жидкой фазой и твердой фазой.
Растворы замерзают при более низкой температуре, чем чистая вода (или другой растворитель).
Кривая АВ (рис. 21) характеризует зависимость от температуры давления насыщенного пара над жидкой водой, а кривая СД – над раствором (сахар в воде). Кривая АМ характеризует зависимость от температуры давления пара надо льдом (твердой водой). Чистая вода замерзает при 0°С, так как при этой температуре (см. точку А) давление пара над жидкой водой и льдом равны.
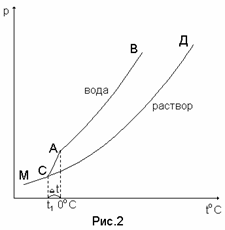
Рисунок 21. Зависимость давления насыщенного пара от температуры
Чтобы давление пара над раствором стало равным давлению пара надо льдом, раствор надо дополнительно охладить (кривые МА и СД пересекаются в точке С, которой соответствует температура t1 – это и будет температура замерзания раствора и она меньше, чем 0°С, то есть меньше температуры замерзания чистой воды.
Понижение температуры замерзания раствора (Dtзам.) прямо пропорционально моляльной концентрации раствора (сm).
Dtзам. = К× Сm – это следствие из закона Рауля для замерзания раствора,
где Dtзам. – разность между температурой замерзания воды и раствора, т.е. Dtзам. = tзам.(Н2О) - tзам. (раствора).
К – криоскопическая постоянная (криос – холод), она зависит от природы растворителя и приводится в справочниках (например, для воды К = 1,86°).
3. Осмос и осмотическое давление растворов неэлектролитов. Биологическое значение осмоса и осмотического давления
Осмос является частным случаем диффузии.
Осмос – это односторонняя (®) диффузия молекул растворителя через полупроницаемую перегородку (в качестве такой перегородки могут быть целлофан, пергамент, стенки мочевого пузыря). Такие перегородки пропускают только молекулы растворителя (воды).
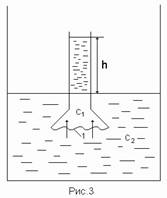
Рисунок 22. Осмос
Возьмем сосуд (рис. 22) с полупроницаемой перегородкой 1. Концентрация раствора (например, сахар в воде) во внешнем сосуде равна с2, а во внутреннем сосуде равна с1, причем с1>с2. Молекулы воды будут преимущественно перемещаться из внешнего сосуда во внутренний (так как с1>с2), а молекулы сахара не смогут проходить через полупроницаемую перегородку. В результате перемещения молекул воды во внутренний сосуд (в более концентрированный раст-вор) уровень жидкости в этом сосуде будет подниматься на высоту h.
Сила, обуславливающая осмос, называется осмотическим давлением, которое и заставляет жидкость подниматься во внутреннем сосуде. Подъем жидкости на высоту h будет происходить до тех пор, пока осмотическое давление не станет равным гидростатическому давлению, то есть давлению столба (высотой h) жидкости.
Осмотическое давление можно определить по закону Вант-Гоффа, который гласит:
Осмотическое давление раствора неэлектролита при постоянной температуре (Т) прямо пропорционально молярной концентрации растворенного вещества (см) в растворе.
росм. = См ×R×T,
где Т – температура, °К;
R – 8,314 Дж/моль×К;
См – молярная концентрация, моль/л;
росм. – осмотическое давление, кПа (килопаскали).
Осмос очень важен. Осмос и осмотическое давление осуществляют процессы движения веществ по организму. За счет осмоса осуществляется питание клеток (стенки клеток избирательно пропускают питательные вещества) и выделение продуктов распада, то есть осуществляется обмен веществ. Благодаря осмотическому давлению органы и ткани имеют эластичность и упругость. Осмотическое давление крови равно 7,6-7,8 атм,, поэтому при больших потерях крови вводится физиологический раствор – это 0,9%-ный водный раствор NaCl, который имеет такое же осмотическое давление как и кровь.
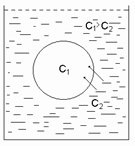
Если клетку с концентрацией с1 поместить в раствор, в котором концентрация с2 (причем с1>с2), то осмос будет направлен в клетку, то есть растворитель будет проникать в клетку, которая будет разбухать (увеличиваться) и может разрушиться, то есть лопнуть – это явление называется гемолиз.
И, наоборот, если с1<с2, то осмос направлен из клетки в окружающую среду, то есть растворитель из клетки поступает в окружающую среду, поэтому клетка будет сжиматься, то есть происходит высыхание клетки – это плазмолиз.
Таким образом, осмос всегда направлен в сторону раствора с большей концентрацией.
Если мы сравниваем осмотические давления двух растворов, то возможны 3 случая:
1) Из двух растворов гипертоническим будет тот раствор, у которого больше концентрация всех растворенных частиц, а, значит, больше осмотическое давление. Например, 2%-ный раствор NaCl будет гипертоническим по отношению к 0,9%-ному раствору NaCl.
2) Из двух растворов гипотоническим будет тот раствор, у которого меньше концентрация всех растворенных частиц, а, значит, меньше осмотическое давление. Например, 0,9%-ный раствор NaCl будет гипотоническим по отношению к 2%-ному раствору NaCl.
3) Изотонические растворы – это растворы с одинаковым осмотическим давлением, то есть одинаковой концентрацией растворенных частиц. Например, 0,9%-ный раствор NaCl изотоничен крови, так как у них осмотические давления одинаковы.
До сих пор мы рассматривали коллигативные свойства для растворов неэлектролитов. Если теперь возьмем растворы электролитов (например, водный раствор NaCl), то для них осмотическое давление, повышение температуры кипения (Dtкип.) и понижение температуры замерзания (Dtзам.) растворов будет больше, чем для растворов неэлектролитов той же концентрации. Вант-Гофф такое несоответствие результатов растворов электролитов по сравнению с растворами неэлектролитов объяснил ионизацией (диссоциацией) электролитов в растворе, в результате чего увеличивается общее число частиц в растворе электролита по сравнению с раствором неэлектролита.
Чтобы применить законы Вант-Гоффа и Рауля к растворам электролитов, Вант-Гофф ввел поправочный коэффициент (в виде сомножителя, который называется изотоническим коэффициентом (i)).
Таким образом, для растворов электролитов получаем:
росм. = i×См×RT
Dtкип. = i×E×Сm
Dtзам. = i×K×Сm
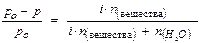
Изотонический коэффициент (i) связан со степенью диссоциации (a) соотношением:

где n – число ионов, получаемых при диссоциации одной “молекулы” электролита.
Например, для NaCl n = 2, для K2SO4 n = 3.
|
|
Дата добавления: 2014-01-07; Просмотров: 4869; Нарушение авторских прав?; Мы поможем в написании вашей работы!