
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы, определяющие положение электронов в атоме
|
|
|
|
1.Любая частица стремится к минимальному запасу потенциальной энергии.
2. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел. Запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней. Электронная ёмкость уровней рассчитывается по формуле: N = 2n2, где N – число электронов на данном уровне, n – главное квантовое число.
3. Принцип Хунда. На данном энергетическом подуровне электроны располагаются таким образом, чтобы модуль их суммарного спина был максимальным.
4. Первый закон Клечковского. Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел. Согласно первому закону Клечковского, в первую очередь заполняются электронами ns-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
5. Второй закон Клечковского. Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
6. Порядок заполнения атомных орбиталей.
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
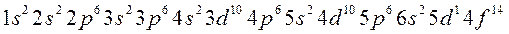
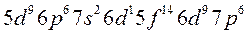
ЛЕКЦИЯ 2
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 360; Нарушение авторских прав?; Мы поможем в написании вашей работы!