
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Шестичленные гетероциклы
|
|
|
|
Качественные реакции.
1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).
Получение. Основной способ получения аминокислот — замещение атома галогена на аминогруппу в галогензамещенных кислотах. Этот способ аналогичен получению аминов из алкилгалогенидов и аммиака. Выделяющийся при замещении галогеноводород связывают избытком аммиака:
Cl-CH(R)-COOH + 2NH3 → H2N-CH(R)-COOH + NH4Cl.
Вопросы для закрепления темы:
1. Какие вещества называются аминокислотами?
2. Как классифицируются аминокислоты?
3. Какие физические свойства характерны аминокислотам?
4. Какие качественные реакции характерны для аминокислот?
5. Какие виды изомерии характерны для аминокислот?
6. Где применяются аминокислоты?
7. Что образуется в результате реакции поликонденсации аминокислот?
8. Какие способы получения аминокислот вы знаете?
9. Что собой представляет биполярный ион?
Лекция № 31: Понятие о гетероциклических соединениях.
Гетероциклические соединения — органические соединения, содержащие в своих молекулах циклы, в образовании которых принимают участие неуглеродные атомы (гетероатомы). Гетероциклические соединения классифицируют по числу атомов в цикле и по типу гетероатома.
|
|
|
Пиридин C5H5N - простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
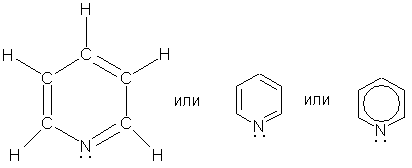
Строение. По электронному строению пиридин напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации. Шесть электронов (по одному от каждого атома), находящихся на негибридных орбиталях, образуют p-электронную ароматическую систему. Из трех гибридных орбиталей атома азота две вступают в образование σ-связей C-N, а третья содержит неподеленную пару электронов.
Физические свойства. Пиридин — бесцветная жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях.
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
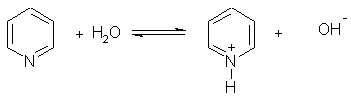
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины (Кb = 1,7.10-9). Его водный раствор окрашивает лакмус в синий цвет:
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
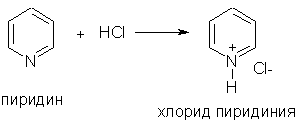
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
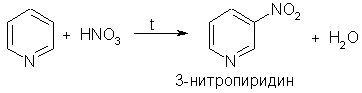
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
|
|
|
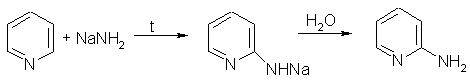
3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
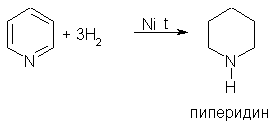
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
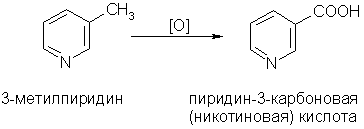
Никотиновая кислота и ее амид — важные лекарственные препараты
Пиримидин C 4H 4N 2 - шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:
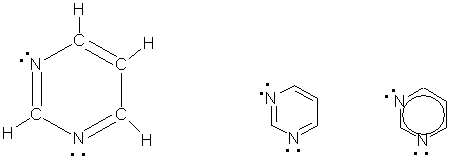
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
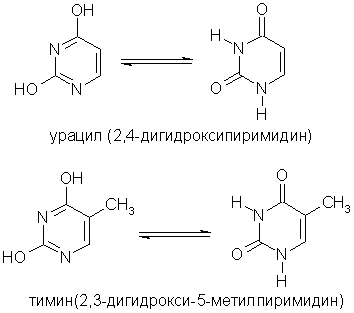
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
Пиримидиновые основания - производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
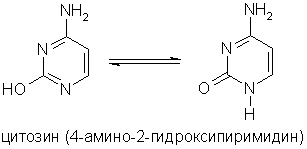
Получение. Пиридин выделяют из каменноугольной смолы, в которой его содержание 0,08%. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
2HC≡CH + HC≡N → C5H5N.
Вопросы для закрепления темы:
1. Какие вещества относятся к гетероциклическим соединениям?
2. Как подразделяются гетероциклические соединения?
3. Какие химические свойства для них характерны?
4. Где встречаются гетероциклические соединения?
5. Какие способы получения гетероциклических соединений вы знаете?
Лекция № 32-33: Белки. Нуклеиновые кислоты. Строение. Свойства. Применение.
Белки — это природные полипептиды с высокими значениями молекулярной массы (от 10 000 до десятков миллионов). Они входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Можно выделить четыре уровня в строении полипептидной цепи. Первичная структура белка - это конкретная последовательность аминокислот в полипептидной цепи.
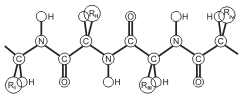
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве
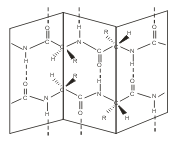
Вторичная структура - это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и СО. Существует два основных способа укладки цепи — α-спираль и β-структура
|
|
|
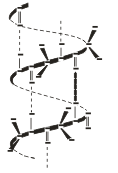
В α-спирали на одном витке укладывается четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями
Большинство белков содержит как α-спирали, так и β-структуры.
Третичная структура белка — это трехмерная конфигурация закрученной α-спирали или β-структуры в пространстве.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп NН3+ и СОО- и гидрофобные взаимодействия, т.е. стремление молекулы белка свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры.
Третичная структура — высшая форма пространственной организации белков. Однако, некоторые белки (например, гемоглобин) имеют четвертичную структуру, которая образуется за счет взаимодействия между разными полипептидными цепями.
Ключевой этап определения структуры белка — расшифровка последовательности аминокислот в первичной структуре. Для этого белок сначала разделяют на полипептидные цепи (если их несколько), а затем анализируют аминокислотный состав цепей путем последовательного отщепления аминокислот. Это — чрезвычайно трудоемкая процедура, поэтому первичная структура надежно установлена только для достаточно простых белков.
Первый белок, у которого была расшифрована первичная структура, — гормон инсулин (1955 г.). Это — простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая - 30 остатков), соединенных двумя дисульфидными мостиками. На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.
|
|
|


Пространственную структуру белков анализируют, изучая данные рассеяния рентгеновского излучения (рентгеноструктурный анализ) или нейтронов (нейтронография). Часто применяют также спектроскопические методы, особенно для исследования структуры белков в водных растворах.
Принципиальная возможность синтеза белков была доказана на примере двух гормонов — вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки — инсулин и рибонуклеаза (124 аминокислотных остатка).
Для синтеза белков широко используют твердофазный метод, разработанный в начале 1960-х гг. американским химиком Б.Меррифилдом. В этом методе первая аминокислота закрепляется на полимерном носителе, и к ней последовательно подшиваются новые аминокислоты. По окончании синтеза готовая полипептидная цепь отрывается от носителя.
В настоящее время искусственное получение белков осуществляется не с помощью химического, а с помощью микробиологического синтеза, путем использования микроорганизмов.
В живой природе синтез белков происходит чрезвычайно быстро, всего за несколько секунд. Живые клетки — это хорошо организованные «фабрики», в которых четко налажена система поставки сырья (аминокислот) и технология сборки. Информация о первичной структуре всех белков организма содержится в дезоксирибонуклеиновой кислоте (ДНК).
Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина) дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
Биологическое значение белков чрезвычайно велико.
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма.
Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты - вирусы, бактерии, чужие клетки.
5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называются незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин.
Нуклеиновые кислоты — это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекулярная масса нуклеиновых кислот может меняться от 100 тыс. до 60 млрд. Они были открыты и выделены из клеточных ядер еще в XIX веке, однако их биологическая роль была выяснена только во второй половине XX века.
Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь пиримидиновых и пуриновых оснований, моносахарид (β-рибоза или β-дезоксирибоза) и фосфорная кислота. Это означает, что нуклеиновые кислоты построены из фрагментов этих веществ.
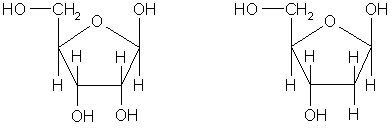
β-рибоза β-дезоксирибоза
(C5H10O5) (C5H10O4)
Нуклеотид - основная структурная единица нуклеиновых кислот, их мономерное звено. Нуклеиновые кислоты, состоящие из рибонуклеотидов, называются рибонуклеиновые кислоты (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называются дезоксирибонуклеиновые кислоты (ДНК). В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил. В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. Для обозначения оснований используют однобуквенные сокращения: аденин — А, гуанин — G, тимин — Т, цитозин — С, урацил — U.
Свойства ДНК и РНК определяются последовательностью оснований в полинуклеотидной цепи и пространственным строением цепи. Последовательность оснований содержит генетическую информацию, а остатки моносахаридов и фосфорной кислоты играют структурную роль (носители оснований).
При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного с остатком моносахарида — рибозы или дезоксирибозы.
Пространственная структура полинуклеотидных цепей ДНК и РНК была определена методом рентгеноструктурного анализа. Одним из самых крупных открытий биохимии XX века оказалась модель трехмерной структуры ДНК, которую предложили в 1953 г. Дж.Уотсон и Ф.Крик. Эта модель состоит в следующем.
1. Молекула ДНК представляет собой двойную спираль и состоит из двух полинуклеотидных цепей, закрученных в противоположные стороны вокруг общей оси.
2. Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы — снаружи.
3. Диаметр спирали 20 А (2 нм), расстояние между соседними основаниями вдоль оси спирали 3,4 А, они повернуты относительно друг друга на 36°. Таким образом, на полный виток спирали (360°) приходится 10 нуклеотидов, что соответствует длинеспирали по оси 34 А.
4.Две спирали удерживаются вместе водородными связями между парами оснований. Важнейшее свойство ДНК — избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) — только с гуанином (G).
Две спирали в молекуле ДНК комплементарны друг другу. Последовательность нуклеотидов в одной из спиралей однозначно определяет последовательность нуклеотидов в другой спирали. В каждой паре оснований, связанных водородными связями, одно из оснований — пуриновое, а другое — пиримидиновое. Отсюда следует, что общее число остатков пуриновых оснований в молекуле ДНК равно числу остатков пиримидиновых оснований.
Двухспиральная структура ДНК с комплементарными полинуклеотидными цепями обеспечивает возможность самоудвоения (репликации) этой молекулы. Этот сложный процесс можно упрощенно представить следующим образом.
Перед удвоением водородные связи разрываются, и две цепи раскручиваются и расходятся. Каждая цепь затем служит матрицей для образования на ней комплементарной цепи.
Таким образом, после репликации образуются две дочерние молекулы ДНК, в каждой из которых одна спираль взята из родительской ДНК, а другая (комплементарная) спираль синтезирована заново. Синтез новых цепей происходит с участием фермента ДНК-полимеразы.
Длина полинуклеотидных цепей ДНК практически неограничена. Число пар оснований в двойной спирали может меняться от нескольких тысяч у простейших вирусов до сотен миллионов у человека. Каждой тысяче пар оснований соответствует длина оси спирали (называемая контурной длиной) 3400 А и молекулярная масса примерно 660 тыс.
В отличии от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи. Число нуклеотидов в цепи колеблется от 75 до нескольких тысяч, а молекулярная масса РНК может изменяться в пределах от 2500 до нескольких млн.
Вопросы для закрепления темы:
1. Какие вещества называются белками?
2. Назовите структуры белка?
3. Из каких соединений состоят белки?
4. Какова биологическая роль белков?
5. Какими способами можно получить белок?
6. Какие реакции называются «цветными реакциями»?
7. Какие вещества относятся к нуклеиновым кислотам?
8. Что называется комплементарностью?
9. Кем и в каком году была открыта структура ДНК?
10. Что называется денатурацией белка?
Лекция № 34: Основные понятия химии высокомолекулярных соединений.
Наука о полимерах стала развиваться как самостоятельная область знания к началу Второй мировой войны и сформировалась как единое целое в 50-х гг. XX столетия, когда была осознана роль полимеров в развитии технического прогресса и жизнедеятельности биологических объектов. Она тесно связана с физикой, физической, коллоидной и органической химией и может рассматриваться как одна из базовых основ современной молекулярной биологии, объектами изучения которой являются биополимеры.
Полимеры (греч. πολύ- — много; μέρος — часть) — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются. Как правило, полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов.
Мономер (др.-греч. μόνος — один; μέρος — часть) — это вещество, способное к полимеризации.
Структурное звено – это часто повторяющаяся часть полимера.
Степень полимеризации - это число, показывающее сколько раз встречается структурное звено.
Полимеры можно получить при реакции полимеризации и поликонденсации.
Реакцией полимеризации называется реакция получения ВМС из низкомолекулярного вещества.
Реакция поликонденсации это реакция получения полимера из мономера и сопутствующего низкомолекулярного вещества.
Если связь между макромолекулами осуществляется с помощью слабых сил Ван-Дер-Ваальса, они называются термопласты, если с помощью химических связей — реактопласты. К линейным полимерам относится, например, целлюлоза, к разветвленным, например, амилопектин, есть полимеры со сложными пространственными трёхмерными структурами.
В строении полимера можно выделить мономерное звено — повторяющийся структурный фрагмент, включающий несколько атомов. Полимеры состоят из большого числа повторяющихся группировок (звеньев) одинакового строения, например поливинилхлорид (—СН2—CHCl—)n, каучук натуральный и др. Высокомолекулярные соединения, молекулы которых содержат несколько типов повторяющихся группировок, называют сополимерами или гетерополимерами.
Полимер образуется из мономеров в результате реакций полимеризации или поликонденсации. К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, полисахариды, каучук и другие органические вещества. В большинстве случаев понятие относят к органическим соединениям, однако существует и множество неорганических полимеров. Большое число полимеров получают синтетическим путём на основе простейших соединений элементов природного происхождения путём реакций полимеризации, поликонденсации и химических превращений. Названия полимеров образуются из названия мономера с приставкой поли-: полиэтилен, полипропилен, поливинилацетат и т. п.
Классификация.
По химическому составу все полимеры подразделяются на органические, элементоорганические, неорганические.
По форме макромолекул полимеры делят на линейные, разветвленные (частный случай — звездообразные), ленточные, плоские, гребнеобразные, полимерные сетки и так далее.
Полимеры подразделяют по полярности (влияющей на растворимость в различных жидкостях). Полярность звеньев полимера определяется наличием в их составе диполей — молекул с разобщенным распределением положительных и отрицательных зарядов. В неполярных звеньях дипольные моменты связей атомов взаимно компенсируются. Полимеры, звенья которых обладают значительной полярностью, называют гидрофильными или полярными. Полимеры с неполярными звеньями — неполярными, гидрофобными. Полимеры, содержащие как полярные, так и неполярные звенья, называются амфифильными. Гомополимеры, каждое звено которых содержит как полярные, так и неполярные крупные группы, предложено называть амфифильными гомополимерами.
По отношению к нагреву полимеры подразделяют на термопластичные и термореактивные. Термопластичные полимеры (полиэтилен, полипропилен, полистирол) при нагреве размягчаются, даже плавятся, а при охлаждении затвердевают. Этот процесс обратим. Термореактивные полимеры при нагреве подвергаются необратимому химическому разрушению без плавления. Молекулы термореактивных полимеров имеют нелинейную структуру, полученную путём сшивки (например, вулканизация) цепных полимерных молекул. Упругие свойства термореактивных полимеров выше, чем у термопластов, однако, термореактивные полимеры практически не обладают текучестью, вследствие чего имеют более низкое напряжение разрушения.
Природные органические полимеры образуются в растительных и животных организмах. Важнейшими из них являются полисахариды, белки и нуклеиновые кислоты, из которых в значительной степени состоят тела растений и животных и которые обеспечивают само функционирование жизни на Земле. Считается, что решающим этапом в возникновении жизни на Земле явилось образование из простых органических молекул более сложных — высокомолекулярных.
Особые механические свойства:
эластичность — способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки);
малая хрупкость стеклообразных и кристаллических полимеров (пластмассы, органическое стекло);
способность макромолекул к ориентации под действием направленного механического поля (используется при изготовлении волокон и плёнок).
Особенности растворов полимеров:
высокая вязкость раствора при малой концентрации полимера;
растворение полимера происходит через стадию набухания.
Особые химические свойства:
способность резко изменять свои физико-механические свойства под действием малых количеств реагента (вулканизация каучука, дубление кож и т. п.).
Особые свойства полимеров объясняются не только большой молекулярной массой, но и тем, что макромолекулы имеют цепное строение и обладают гибкостью.
Синтетические полимеры. Искусственные полимерные материалы.. Это кожа, меха, шерсть, шёлк, хлопок, используемые для изготовления одежды, различные связующие (цемент, известь, глина), образующие при соответствующей обработке трёхмерные полимерные тела, широко используемые как строительные материалы. Однако промышленное производство цепных полимеров началось в начале XX в., хотя предпосылки для этого появились ранее.
Практически сразу же промышленное производство полимеров развивалось в двух направлениях — путём переработки природных органических полимеров в искусственные полимерные материалы и путём получения синтетических полимеров из органических низкомолекулярных соединений.
В первом случае крупнотоннажное производство базируется на целлюлозе. Первый полимерный материал из физически модифицированной целлюлозы — целлулоид — был получен ещё в начале XX в. Крупномасштабное производство простых и сложных эфиров целлюлозы было организовано до и после Второй мировой войны и существует до настоящего времени. На их основе производят плёнки, волокна, лакокрасочные материалы и загустители. Необходимо отметить, что развитие кино и фотографии оказалось возможным лишь благодаря появлению прозрачной плёнки из нитроцеллюлозы.
Производство синтетических полимеров началось в 1906 г., когда Л. Бакеланд запатентовал так называемую бакелитовую смолу — продукт конденсации фенола и формальдегида, превращающийся при нагревании в трёхмерный полимер. В течение десятилетий он применялся для изготовления корпусов электротехнических приборов, аккумуляторов, телевизоров, розеток и т. п., а в настоящее время чаще используется как связующее и адгезивное вещество.
Благодаря усилиям Генри Форда, перед Первой мировой войной началось бурное развитие автомобильной промышленности сначала на основе натурального, затем также и синтетического каучука. Производство последнего было освоено накануне Второй мировой войны в Советском Союзе, Англии, Германии и США. В эти же годы было освоено промышленное производство полистирола и поливинилхлорида, являющихся прекрасными электроизолирующими материалами, а также полиметилметакрилата — без органического стекла под названием «плексиглас» было бы невозможно массовое самолётостроение в годы войны.
После войны возобновилось производство полиамидного волокна и тканей (капрон, нейлон), начатое ещё до войны. В 50-х гг. XX в. было разработано полиэфирное волокно и освоено производство тканей на его основе под названием лавсан или полиэтилентерефталат. Полипропилен и нитрон — искусственная шерсть из полиакрилонитрила, — замыкают список синтетических волокон, которые использует современный человек для одежды и производственной деятельности. В первом случае эти волокна очень часто сочетаются с натуральными волокнами из целлюлозы или из белка (хлопок, шерсть, шёлк). Эпохальным событием в мире полимеров явилось открытие в середине 50-х годов XX столетия и быстрое промышленное освоение катализаторов Циглера-Натта, что привело к появлению полимерных материалов на основе полиолефинов и, прежде всего, полипропилена и полиэтилена низкого давления (до этого было освоено производство полиэтилена при давлении порядка 1000 атм.), а также стереорегулярных полимеров, способных к кристаллизации. Затем были внедрены в массовое производство полиуретаны — наиболее распространенные герметики, адгезивные и пористые мягкие материалы (поролон), а также полисилоксаны — элементорганические полимеры, обладающие более высокими по сравнению с органическими полимерами термостойкостью и эластичностью.
Список замыкают так называемые уникальные полимеры, синтезированные в 60-70 гг. XX в. К ним относятся ароматические полиамиды, полиимиды, полиэфиры, полиэфиркетоны и др.; непременным атрибутом этих полимеров является наличие у них ароматических циклов и (или) ароматических конденсированных структур. Для них характерно сочетание выдающихся значений прочности и термостойкости.
Применение. Благодаря ценным свойствам полимеры применяются в машиностроении, текстильной промышленности, сельском хозяйстве и медицине, автомобиле- и судостроении, авиастроении, в быту (текстильные и кожевенные изделия, посуда, клей и лаки, украшения и другие предметы). На основании высокомолекулярных соединений изготовляют резины, волокна, пластмассы, пленки и лакокрасочные покрытия. Все ткани живых организмов представляют высокомолекулярные соединения.
Вопросы для закрепления темы:
1. Что называется ВМС?
2. Из чего состоит полимер?
3. Что называется реакцией полимеризации?
4. В чем отличие реакции полимеризации и поликонденсации?
5. Как подразделяются полимеры?
6. Какие полимеры называются термопластиками?
7. От чего зависит химическая стойкость полимеров?
8. Отличаются ли свойства природных и искусственных полимеров?
9. Какими свойствами обладают термореактивные полимеры?
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!