
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса
|
|
|
|
Протекание любой химической реакции определяется двумя факторами. Первый фактор - энтальпийный (D Н) - определяет изменение энергии системы. Второй фактор - энтропийный (T D S) - определяет изменение неупорядоченности системы. Таким образом протеканию химической реакции способствует уменьшение энергии системы и переход ее в более неупорядоченное состояние.
Для учета энтальпийного и энтропийного факторов в химической реакции, протекающей при постоянном давлении и температуре, в термодинамике была введена новая функция - изобарно-изотермический потенциал или энергия Гиббса (G). Энергия Гиббса связана с энтальпией и энтропией уравнением Гиббса:
D G = D H - T D S.
В любой закрытой системе при постоянном давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса. Следовательно условием принципиальной возможности химической реакции является неравенство:
D G Х.Р. < 0.
В случае, когда D G Х.Р. > 0, самопроизвольное протекание реакции невозможно. Если D G Х.Р. = 0, система находится в состоянии химического равновесия.
Вклад энтропийного и энтальпийного факторов значительно зависит от температуры.
При низких температурах T ® 0, следовательно T D S ® 0 и D G» D H. Доминирующим становится энтальпийный фактор, поэтому при низких температурах, как правило, самопроизвольно протекают экзотермические реакции (D H Х.Р.<0).
При высоких температурах T ® ¥, следовательно | T D S | >> |D H | и D G» - T D S. Доминирующим становится энтропийный фактор, поэтому при высоких температурах, как правило, самопроизвольно протекают реакции, ведущие к увеличению энтропии (D S Х.Р.>0).
Таким образом при анализе возможности самопроизвольного протекания химической реакции необходим одновременный учет энтальпийного и энтропийного факторов (см. табл. 1.1).
|
|
|
В термодинамических расчетах широко используется понятие стандартной энергии Гиббса образования вещества. Стандартной энергией Гиббса образования сложного вещества называется изменение энергии Гиббса при образовании 1 моль данного соединения из простых веществ при стандартных условиях. Данную величину принято обозначать D f G °298, а размерность выражать в кДж/моль. В данном методическом указании значения D f G °298 наряду с другими термодинамическими характеристиками веществ приведены в табл. 4.1 на с.23-24.
Стандартная энергия Гиббса образования простых веществ, находящихся в наиболее устойчивом в стандартных условиях фазовом состоянии, равна нулю.
Стандартная энергия Гиббса образования сложных веществ может служить мерой их термодинамической устойчивости относительно разложения на простые вещества: чем меньше ее значение, тем более устойчивым является вещество. Так D f G °298(NH3(Г)) = -16.71 кДж/моль, а D f G °298(PH3(Г)) = 13.4 кДж/моль, поэтому аммиак (NH3) является более стабильным соединением, чем фосфин (PH3).
Таблица 1.1. Учет энтальпийного и энтропийного факторов при оценке возможности самопроизвольного протекания реакции.
| Знак изменения функции | Возможность протекания химической реакции | Пример химической реакции | ||
| D H Х.Р. | D S Х.Р. | D G Х.Р. | ||
| - <0 | + >0 | - <0 | Реакция возможна в любом интервале температур | C3H8 (Г) + 5O2 (Г) = 3CO2 (Г) + 4H2O(Г) |
| + >0 | - <0 | + >0 | Реакция невозможна в любом интервале температур | 2Sb(ТВ) + 3H2 (Г) = 2SbH3 (Г) |
| - <0 | - <0 | ± | Реакция возможна лишь при низких температурах, когда |D H | > | T D S | | 2H2 (Г) + O2 (Г) = 2H2O (Г) |
| + >0 | + >0 | ± | Реакция возможна лишь при высоких температурах, когда |D H | < | T D S | | H2 (Г) + I2 (Г) = 2HI (Г) |
Изменение энергии Гиббса в ходе химической реакции можно рассчитать как разность между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ по формуле:
|
|
|
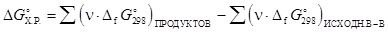 ,
,
где n - стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1650; Нарушение авторских прав?; Мы поможем в написании вашей работы!