
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Необратимые реакции первого порядка
|
|
|
|
Необратимые реакции первого, второго, n-го и нулевого порядка
Примеры: 2N2O5 ® 2N2O4 + O2,
CH3OCH3 ® CH4 + H2 + CO
В общем виде уравнение необратимой реакции первого порядка можно записать следующим образом:
А ® n1 В + n2 С +....
Выведем кинетическое уравнение реакции первого порядка. Пусть в начальный момент времени имеется а моль исходного вещества А. Если к моменту t прореагировало х моль вещества, то в смеси осталось (а - х) моль. Тогда концентрация вещества А в момент времени t равна
СА =  .
.
Скорость реакции первого порядка (согласно определению) прямо пропорциональна концентрации реагирующего вещества в первой степени. Объединяя основное кинетическое уравнение с выражением для скорости химической реакции, получим
-  = k
= k  / × V;
/ × V;
 = k (a - x).
= k (a - x).
Разделим переменные и проинтегрируем:
 = k dt, - ln (a - x) = kt + сonst.
= k dt, - ln (a - x) = kt + сonst.
Найдем сonst: если t = 0, х = 0 и - ln a = сonst.
kt = ln a - ln (a - x);
k = 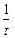 ln
ln 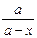 / a: V, (a - x): V;
/ a: V, (a - x): V;
k = 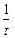 ln
ln 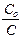 ,
,
где Со - исходная концентрация вещества, С - его концентрация к моменту времени t. [ k ] = t –1: с –1, мин –1, час–1.
Освобождаясь от ln, получим
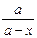 = еkt, (a - x) = ae-kt, x = a (1 - e-kt).
= еkt, (a - x) = ae-kt, x = a (1 - e-kt).
По этим уравнениям можно определить количество (a - x) вещества А, не прореагировавшее к моменту t, и количество х этого вещества, прореагировавшее к моменту t (иначе - количество вещества В, образовавшегося к моменту t).
Видно (из рис. 1 и из уравнений), что полное исчезновение исходного вещества произойдет через бесконечно большой промежуток времени. В практических расчетах за конец реакции принимается момент, когда исходное вещество невозможно обнаружить аналитическим способом.
В точке пересечения
а - х = х или х = а /2,
то есть к моменту t прореагирует половина исходного вещества. Поэтому время t называют временем полураспада (периодом полупревращения).
|
|
|
ае-kt = a (1 - e-kt);
2 e-kt = 1, ekt = 2, t = ln 2 / k.
Таким образом, tне зависит от количества исходного вещества. Это понятно, так как в случае мономолекулярных процессов превращение молекул является спонтанным (не зависящим от присутствия остальных).
Кол-во в-ва х
а /2
а – х
t t | Рис. 1. Кинетическая кривая для необратимой реакции первого порядка |
Величина, обратная k (константе скорости мономолекулярной реакции), имеет физический смысл средней продолжительности жизни отдельной молекулы.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1468; Нарушение авторских прав?; Мы поможем в написании вашей работы!
