
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Миграция и диффузия
|
|
|
|
Миграция представляет собой передвижение ионов (или других заряженных частиц) под действием градиента электрического поля dU / dx, возникающего в электролите при прохождении тока через электрохимическую систему. Явление миграции лежит в основе электропроводности электролитов.
Различают удельную, эквивалентную и мольную электропроводность электролитов.
Электропроводность К - величина, обратная электрическому сопротивлению R. Так как
R = r 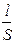 , то К =
, то К = 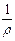 ×
× 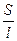 = k
= k 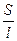 ,
,
где r - удельное электрическое сопротивление; l - расстояние между электродами; S - площадь электрода; k - удельная электропроводность.
Удельная электропроводность k жидкости - это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. [k] = Ом–1× см–1.
Физический смысл k: по закону Ома R = U/I, K = I/U; I = i × S (i - плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S - площадь электрода); U = E × l (Е - напряженность поля, или падение напряжения на 1 см расстояния; l - расстояние между электродами). Тогда
k 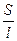
 =
= 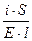 ; i = k× E.
; i = k× E.
При Е = 1 В/см i = k.
I = 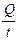 ; i =
; i =  .
.
Таким образом, k - это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум, четко выраженный для сильных электролитов и сглаженный для слабых.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением
|
|
|
kt = k18 × [1 + a (t – 18)],
где a - температурный коэффициент электропроводности (a > 0); k18 (k25) - стандартное значение. Коэффициент a зависит от природы электролита; он равен для сильных кислот 0,0164, для сильных щелочей 0,0190, для солей 0,0220. В случае слабых электролитов a больше, чем для сильных. Следует отметить, что температурные коэффициенты электропроводности водных растворов и вязкости воды близки по своей величине, но обратны по знаку. Это свидетельствует о том, что увеличение удельной электропроводности с ростом температуры связано, главным образом, с уменьшением вязкости раствора.
Эквивалентная электропроводность l [в см2/(г-экв×Ом)] - это электропроводность такого объема (j см3) раствора, в котором содержится 1 г-экв растворенного вещества; раствор заполняет пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Величина j, равная 1000/с см3/г-экв, называется разведением.
l = k× j; l =  .
.
Мольная электропроводность электролита m - это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации: для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение l с увеличением  , что соответствует эмпирической формуле Кольрауша (закону квадратного корня):
, что соответствует эмпирической формуле Кольрауша (закону квадратного корня):
l = l¥ - А ,
,
где l¥ - предельная эквивалентная электропроводность при бесконечном разведении: с ® 0, j ® ¥. А – эмпирическая постоянная. При несколько более высоких концентрациях сильных электролитов лучшее согласие с опытом дает уравнение, известное под названием закона кубического корня:
l = l¥ - А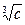 .
.
Для разбавленных растворов слабых электролитов вышеприведенные законы не соблюдаются.
Влияние природы растворителя на электропроводность: электропроводность растворов электролитов зависит, в первую очередь, от природы электролита и растворителя. Основными свойствами растворителя, обусловливающими характер изменения электропроводности, являются его вязкость и диэлектрическая проницаемость.
|
|
|
Повышение вязкости снижает электропроводность. Количественное выражение этого эффекта дается правилом Вальдена – Писаржевского:
lоhо = const,
lо – мольная электропроводность электролита, экстраполированная до нулевой концентрации; hо – вязкость чистого растворителя. Правило Вальдена – Писаржевского приближенно и оправдывается лишь для растворителей с близкими величинами диэлектрических проницаемостей.
Скорости движения катиона u¢ и аниона v¢ (см/с) зависят от природы ионов, напряженности электрического поля U/ l, концентрации, Т, вязкости среды и т.п. Скорость ионов пропорциональна приложенной силе, то есть напряженности поля
u¢ = u  , v¢ = v
, v¢ = v  ,
,
где u, v - скорости ионов в стандартных условиях, при напряженности поля, равной 1 В/см; они называются абсолютными подвижностями ионов и измеряются в см2/(с×В).
u×F и v×F - это скорости движения ионов, выраженные в электростатических единицах; они называются ионными электропроводностями (или просто подвижностями ионов):
u×F = l+, v×F = l–.
Для сильных электролитов l = l+ + l–,
для слабых l = (l+ + l–)×a.
При бесконечном разведении (j ® ¥, a ® 1)
l¥ = lо+ + lо–
как для сильных, так и для слабых электролитов. Величины lо+ и lо– являются предельными электропроводностями (предельными подвижностями) ионов. Они равны эквивалентным электропроводностям катиона и аниона при бесконечном разведении и измеряются в тех же единицах, что и l и l¥, то есть в см2/(Ом×г-экв). Вышеприведенное уравнение является выражением закона Кольрауша: эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов.
Для всех электролитов можно записать
lс = aс ×l¥, aс = lс / l¥.
l+ и l– зависят от концентрации (разведения), особенно для сильных электролитов; lо+ и lо– - табличные величины.
Влияние природы иона (его радиуса и заряда) на величину подвижности иона отражено в формуле Стокса
u = 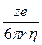 ,
,
где е - заряд электрона; z - число элементарных зарядов иона; r - эффективный радиус иона (радиус гидратированного иона); h - коэффициент вязкости.
|
|
|
Уменьшение подвижности ионов и эквивалентной электропроводности lсильных электролитов с увеличением концентрации объясняется, по теории Дебая и Гюккеля, наличием ионной атмосферы. Из-за наличия ионной атмосферы при движении иона возникают два тормозящих эффекта: электрофоретический, обусловленный движением ионной атмосферы в сторону, противоположную направлению движения иона, и эффект релаксации, обусловленный асимметрией ионной атмосферы.
Онзагер вывел теоретическое уравнение, которое количественно связывает эквивалентную электропроводность с концентрацией и позволяет вычислить электрофоретический и релаксационный эффекты. Уравнение Онзагера имеет следующий вид:
lс = l¥ – (a + b l¥)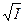 ,
,
где первое слагаемое в скобках характеризует электрофоретический эффект, второе слагаемое характеризует эффект релаксации; a и b зависят от заряда ионов, Т, диэлектрической проницаемости растворителя D и вязкости растворителя h. Для 1-1 валентного электролита
lс = l¥ – [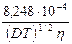 +
+ 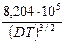 l¥]
l¥]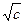 .
.
По виду уравнение совпадает с эмпирическим законом квадратного корня Кольрауша. Оно позволяют теоретически предсказать численное значение константы А уравнения Кольрауша. Формула Онзагера согласуется с опытными данными в той области концентраций, где приложим закон квадратного корня. При увеличении концентрации сходимость с опытом уменьшается.
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов:
t+ = 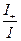 , t– =
, t– = 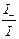 , t+ + t– =
, t+ + t– = 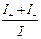 = 1;
= 1;
I+ = 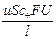 , I– =
, I– = 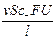 , I = I+ + I– =
, I = I+ + I– = 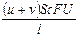 ;
;
t+ = 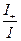 =
= 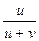 =
= 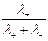 , t– =
, t– = 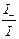 =
= 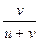 =
=  .
.
Таким образом, число переноса равно отношению скорости движения (или подвижности) данного иона к сумме скоростей движения (или подвижностей) катиона и аниона. Так как подвижности катиона и аниона изменяются с концентрацией и температурой в общем случае неодинаково, то и числа переноса зависят от концентрации и температуры, хотя эта зависимость более слабая. Приведенные соотношения позволяют вычислить числа переноса, если известны значения подвижностей ионов. С другой стороны, опытное определение чисел переноса дает возможность вычислить подвижности.
|
|
|
Экспериментально числа переноса определяются по изменению концентрации ионов у электродов (метод Гитторфа):
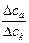 =
= 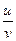 =
= 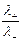 .
.
Числа переноса определяются из соотношений
t+ = 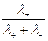 =
= 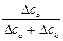 , t– =
, t– = 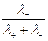 =
= 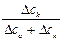 ,
,
где Dск – убыль электролита у катода, а Dса – убыль электролита у анода в ходе электролиза.
Определенные по методу Гитторфа числа переноса называются кажущимися числами переноса; они не являются истинными, так как этот метод не учитывает сольватации ионов. Измеряемые в методе Гитторфа концентрации определяются не только количеством катионов и анионов, но и количеством растворителя, перенесенного этими ионами в виде сольватных оболочек. Оболочки ионов разных знаков неодинаковы по величине.
Молекулярная диффузия представляет собой перемещение частиц под действием градиента химического потенциала d m/ dx, или приближенно – градиента концентрации dc/dx, возникающего в растворе в результате его качественной или количественной неоднородности. Молекулярная диффузия описывается законами Фика. Первый закон Фика описывает стационарную диффузию незаряженных частиц:
d ni = – D i S  d t,
d t,
где ni – число частиц, диффундирующих через поперечное сечение S; ci – концентрация частиц; D i – коэффициент диффузии – число i -х частиц, диффундирующих за единицу времени через единичное сечение, размерность коэффициента диффузии – м2/с.
D i = 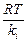 ,
,
где ki – коэффициент трения, откуда получаем, при использовании закона Стокса, уравнение Эйнштейна – Смолуховского:
D i = 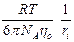 ,
,
где ri – радиус диффундирующей частицы (иона).
В соответствии с гидродинамической теорией электропроводности,
vi = 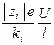 , ui =
, ui =  =
=  ,
,
l i = ui F =  =
=  ,
,
где vi – скорость движения иона (см/с); ui – абсолютная подвижность иона; l i – подвижность иона (ионная электропроводность).
Связь между подвижностью ионов и их коэффициентами диффузии устанавливается уравнением Нернста – Эйнштейна:
D i = 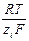 ui,
ui,
аналогичное уравнение передает зависимость между ионными электропроводностями и коэффициентами диффузии:
D i = 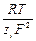 l i.
l i.
Оба уравнения относятся к бесконечно разбавленным растворам.
Диффузионный потенциал на границе двух жидких растворов для практически наиболее важных простых частных случаев можно рассчитать по следующим формулам (по методам Планка и Гендерсона):
1. Растворы одного и того же электролита МА, но разной концентрации:
yD = – 
 ln
ln  .
.
Если вместо концентраций подставить активности, то это уравнение можно применить и для концентрированных растворов
yD = – 
 ln
ln 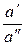 ,
,
где подвижности ионов l– и l+ должны соответствовать их активностям в растворах I и II.
2. Растворы двух различных электролитов с одним общим ионом (например, типа М¢А и М¢¢А), причем концентрации электролитов одинаковы:
yD =  ln
ln  =
=  ln
ln 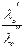
(учитывая, что l+о + l–о = lо ).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3582; Нарушение авторских прав?; Мы поможем в написании вашей работы!