
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость тепловых эффектов реакций от температуры. Уравнение Кирхгофа
|
|
|
|
Для количественной оценки теплоты, которую получает тело при нагревании, используется понятие теплоемкости.
Пусть имеет место необратимая химическая реакция А→В если она протекает при
1) V=const Q v=ΔU (изохорный процесс)
(2.5)
2) p= const Q p=ΔН (изобарный процесс)
Беря производные по температуре, можно записать
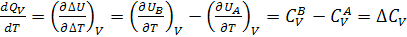 (2.6)
(2.6)
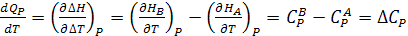 (2.7)
(2.7)
где Cv мольная изохорная теплоемкость;
Cp мольная изобарная теплоемкость (кал/моль∙К, Дж/моль∙К).
Мольная теплоемкость – это количество теплоты, необходимое для нагревания одного моля вещества на один градус.
Итак, изменение теплового эффекта с температурой равно разности теплоемкостей веществ участников реакции. Эти соотношения представляют уравнение Кирхгофа в дифференциальной форме. Для практических целей последнее уравнение интегрируют
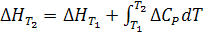 (2.8)
(2.8)
Для расчета 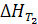 надо знать
надо знать 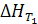 и иметь данные по теплоемкости всех участников реакции в интервале температур от Т1 до Т2. Значения ΔCp для определенного интервала температур табулированы.
и иметь данные по теплоемкости всех участников реакции в интервале температур от Т1 до Т2. Значения ΔCp для определенного интервала температур табулированы.
 (2.9)
(2.9)
Характер изменения ΔH с температурой зависит от того, как изменяется ΔCp. Грубое приближение решения уравнения Кирхгофа имеет место когда ΔCp=0, в этом случае тепловой эффект реакций от температуры не зависит.
Если ΔCp=const,то
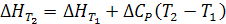 (2.7)
(2.7)
ΔCp ≈ ΔCp, 298 для газов в сравнительно узком интервале температур, для твердых и жидких веществ в достаточно широком температурном интервале.
Для точного решения уравнения Кирхгофа учитывается зависимость Cp=ƒ(Т). Во всех случаях интегрирования в пределах от Т1 до Т2 обычно полагают, что Т1=298º К (25ºС), 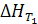 =
= 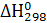
Уравнение Кирхгофа применимо также к агрегатным и полиморфным химическим превращениям.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 949; Нарушение авторских прав?; Мы поможем в написании вашей работы!