
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика, способы выражения концентрации растворов
|
|
|
|
Лекция 7. Растворы неэлектролитов
Вопросы для самопроверки
1. Дайте определение понятия химического равновесия. Что такое обратимые химические реакции?
2. Назовите и оцените критерии химического сродства.
3. Напишите уравнение изотермы реакции Вант-Гоффа, проанализируйте его.
4. Выразите константу равновесия реакции, протекающей в растворе через концентрации и активности. Отличаются ли эти константы друг от друга?
5. Как, исходя из принципа Ле Шателье, предвидеть влияние температуры на константу равновесия?
6. Каким образом описывается равновесие в реальных системах?
7. Каким образом, может быть рассчитана Кр, исходя из термодинамических данных?
8. Как рассчитать тепловой эффект по уравнению изобары химической реакции?
7.1 Общая характеристика, способы выражения концентрации растворов
7.2 Ограниченная взаимная растворимость жидкостей, распределение вещества между двумя жидкими фазами
7.3 Давление пара растворителя над раствором, первый закон Рауля
7.4 Идеальные растворы, отклонения от закона Рауля
Гомогенные системы, состоящие не менее чем из двух компонентов и продуктов их химического взаимодействия, называются растворами.
Растворитель – это компонент, находящийся в избытке или являющийся в чистом состоянии при рассматриваемых p и Т жидкостью (например, вода). Растворенное вещество – газ, жидкость, твердое вещество.
Важнейшей характеристикой раствора является его состав, который определяет раствор как в качественном, так и в количественном отношениях. Состав раствора выражают как количество растворенного вещества, отнесенное к определенному количеству раствора или растворителя. Существует ряд способов выражения количественного состава (концентрации) растворов:
|
|
|
1) Мольная доля Ni
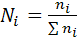 (7.1)
(7.1)
Мольная доля – это отношение числа молей 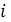 – компонента к сумме числа молей всех компонентов раствора, выражается в долях единицы или в %
– компонента к сумме числа молей всех компонентов раствора, выражается в долях единицы или в %
Для идеальных газов мольная доля может быть выражена также через парциальные давления компонентов р1, р2,…рn и общее давление смеси р:
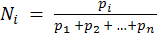 (7.2)
(7.2)
2) Моляльность m – число молей растворенного вещества, содержащегося в 1000 г растворителя.
Эти способы выражения концентрации не зависят от температуры растворов.
Объемные способы выражения концентрации растворов:
3) Молярность М – число молей растворенного вещества, содержащегося в 1 литре раствора.
4) Нормальность n - число грамм-эквивалентов растворенного вещества, содержащегося в 1 литре раствора.
Объемные способы выражения концентрации – функции температуры, т.к. при нагревании раствор расширяется, объем его увеличивается.
На практике используются также весовые доли, коэффициенты растворимости S (количество растворенного вещества в 100 г растворителя), титр раствора Т (число граммов растворенного вещества в 1 мл раствора) и др.
Менделеев рассматривал растворы как неустойчивые химические соединения постоянного состава, находящиеся в состоянии частичной диссоциации, причем равновесие в этих процессах является динамическим. Этим было положено начало современной теории растворов, учитывающей значение не только физического, но и химического взаимодействия между частицами компонентов раствора.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!