
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды халькогенов (VI)
|
|
|
|
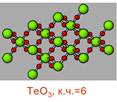
| SО3 | SеО3 | TeО3 | |
| Внешний вид при н.у. | Бесцв. летуч. жидкость с удушающим запахом. Ядовит | Белое твердое вещество, стекловидная и асбестовидная модификация | Желтое твердое вещество |
| Темп. пл., оС | 16,8 | Разл. при 400 | |
| Строение | 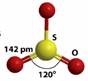 sp2-гибридизация
sp2-гибридизация
| 
| |
| Отношение к воде | Бурно
→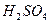
| Очень энергично
→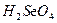
| Не растворим |
Среди триоксидов ЭО3наиболее важен триоксид серы.
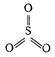
Мономерная газообразная молекула SО3 имеет форму симметричного плоского треугольника с длиной связи S-O 1,43 нм и не обладает дипольным моментом.
В SO3 атом серы находится в состоянии sp2-гибридизации, угол O-S-O равен 120о.
П олучение
В промышленности:
Он производится каталитическим окислением SO2 при 500оС в присутствии катализатора (Pt или V2O5) для получения H2SO4:
2 SO2 +O2 ↔ 2 SO3 + Q.
Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что сместить равновесие в сторону продуктов можно только при понижении температуры. Но при низких температурах сильно падает скорость протекания реакции.
В лаборатории:
Он выделяется при термическом распаде сульфатов металлов:
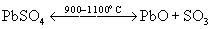
или дисульфатов:
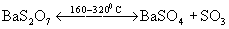 .
.
Химические свойства:
SО3 - одно из самых реакционноспособных соединений.
1. Это – типичные кислотные ангидриды. При взаимодействии с водой образуют кислоты:
SO3 + H2O = H2SO4.
2. Реагируют с основаниями, основными и амфотерными оксидами:
2 NaOH + SO3 = Na2SO4 + H2O,
CaO + SO3 = CaSO4,
Al2O3 + 2 SO3 = Al2(SO4)3.
3. Проявляет сильные окислительные свойства, обычно восстанавливается до SO2:
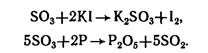
2SO3 + C → 2SO2 + CO2.
SО3 + СО → SO2 + СО2.
Окислительные свойства SО3 усиливаются с температурой.
4. При взаимодействии с HCl образует хлорсульфоновую кислоту: 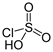
SO3 + HCl = HSO3Cl.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1367; Нарушение авторских прав?; Мы поможем в написании вашей работы!