
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Серная кислота
|
|
|
|
Это сильная кислота (К2=1,3∙10-2). Образует гидраты H2SO4∙nH2O (n=1-4).
Серная кислота и олеум – чрезвычайно агрессивные вещества, поражают дыхательные пути, кожу, слизистые оболочки. ПДК аэрозоля серной кислоты в рабочей зоне составляет 1,0 мг/м3, в воздухе – 0,3 мг/м3.
В молекуле H2SO4 сера тетраэдрически окружена двумя гидроксильными (ОН) группами и двумя атомами кислорода.
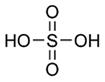
Длины связей (расстояние S- ОН равно 1.54 , а расстояние S- О равно 1.43
, а расстояние S- О равно 1.43 ) в молекуле H2SO4 таковы, что связи S- О можно считать двойными, а связи S- ОН - одинарными.
) в молекуле H2SO4 таковы, что связи S- О можно считать двойными, а связи S- ОН - одинарными.
Серная кислота - тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надо серную кислоту приливать небольшими количествами к воде. H2SO4 смешивается с водой в любых соотношениях, что сопровождается образованием гидратов H2SO4. n H2O. Теплота гидратации настолько велика, что смесь может даже закипеть.
Безводная серная кислота растворяет до 70% оксида серы (VI), образуя олеум. При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% Н2SO4. Безводная Н2SO4 почти не обладает окислительными свойствами.
Схема получения:

- контактный способ: катализатор – платина, платинированный асбест или V2O5. Кислота получается любой концентрации, с малым содержанием примесей. SO3 поглощается серной кислотой, образуется олеум.
- нитрозный способ: катализатор – оксиды азота (NO, NO2). Продукт содержит 78 % H2SO4.
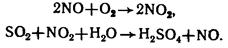
Химические свойства:
H2SeО4 и H2TeО4 – сильные окислители. Серная кислота обладает сильными окислительными свойствами только в концентрированном виде и при нагревании. Продуктами ее восстановления в зависимости от условий проведения реакций могут быть SO2 (при избытке H2SO4), H2S, S, S2O32-, политионаты (при недостатке H2SO4).
|
|
|
Cu + 2 H2SO4 = CuSO4 + SO2 + 2H2O.

S + 2 H2SO4 = 3 SO2 + 2 H2O;
2 Ag + 2 H2SO4 = Ag2SO4 + SO2 + 2 H2O.
Холодная серная кислота пассивирует железо, поэтому ее переносят в железной таре.
Отношение серной кислоты к металлам:
| Ме + H2SO4 (разб) окислитель – Н+ | ||
| Активные (Li – Al) | Средней активности [Al – H2) | Малоактивные (H2 – Au) |
| реагируют | Реагируют Рb реагирует и пассивируется | Не реагируют |
| Ме + H2SO4 (конц) окислитель – S6+ | |||
| Активные (Li – Al) | Средней активности [Al – H2) | Малоактивные (H2 – Au) | |
| реагируют | Реагируют Рb реагирует и пассивируется | Реагируют Cu, Hg | Не реагируют Ag, Au, Ru, Os, Rh, Ir, Pt |
| Кислота восстанавливается, в основном до следующих продуктов | |||
| H2S | S | SO2 | - |
Соли серной кислоты – сульфаты и гидросульфаты. Обычно это бесцветные или белые кристаллические вещества. Большинство сульфатов хорошо растворимы в воде. При нагревании они разлагаются на оксид металла и SO3:
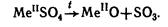
Термическая устойчивость сульфатов увеличивается с ростом активности металла.
При нагревании гидросульфатов образуются пиросульфаты – соли пиросерной кислоты:
2 NaHSO4 = Na2S2O7 + H2O.
При более сильном нагревании происходит отщепление SO3:
Na2S2O7= Na2SO4+ SO3.
4. Тиосерная кислота и тиосульфаты.
Свободная тиосерная кислота H2S2O3 в присутствии воды необратимо распадается по упрощенной схеме:
H2S2O3 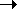 H2SO3 + S
H2SO3 + S 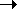 H2O + SO2+ S.
H2O + SO2+ S.
Поэтому выделить ее из водных растворов невозможно. Свободная кислота получена при низкотемпературном взаимодействии сероводорода и хлорсульфоновой кислоты: HSO3Cl + H2S 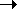 H2S2O3 + HCl.
H2S2O3 + HCl.
Ниже 0оС H2S2O3 количественно распадается: 3H2S2O3 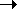 3H2O + 2SO3 + S (интересно сопоставить эту реакцию с распадом серной кислоты H2SO4
3H2O + 2SO3 + S (интересно сопоставить эту реакцию с распадом серной кислоты H2SO4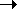 H2O+SO3 выше ее температуры кипения).
H2O+SO3 выше ее температуры кипения).
|
|
|
В отличие от кислоты ее устойчивые соли легко образуются при взаимодействии растворов сульфитов с H2S:
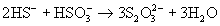
или при кипячении их растворов с серой:
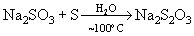 ,
,
а также при окислении полисульфидов кислородом воздуха:
CaS2+ 3/2 O2 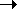 CaS2O3 или
CaS2O3 или
Na2S5 + 3/2 O2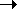 Na2S2O3 +3S.
Na2S2O3 +3S.
В связи с наличием атомов серы в степени окисления - 2 ион S2O32- обладает восстановительными свойствами, например, слабыми окислителями (I2, Fe3+) тиосульфат окисляется до иона тетратионата:
2S2O32- + I2 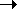 S4 O6 2- + 2I-,
S4 O6 2- + 2I-,
а более сильными окислителями - до иона сульфата:
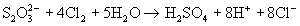
(в связи с использованием в последней реакции ранее тиосульфат называли " антихлором ").
Сильными восстановителями ион  восстанавливается до производных S2-:
восстанавливается до производных S2-:
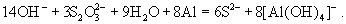
Тиосульфат-ион - сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра:
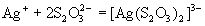 .
.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1126; Нарушение авторских прав?; Мы поможем в написании вашей работы!