
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Факторы, влияющие на растворимость малорастворимого осадка
3.3.1 Растворимость осадка в присутствии избытка иона ‑ осадителя
Растворимость осадка существенно изменяется, если в раствор вводится не стехиометрическое, а избыточное по отношению к стехиометрии количество осадителя (см. таблицу 3.3).
В приближенных расчетах принимают 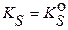 и используют справочные значения
и используют справочные значения 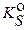 . Анализ уравнений (3.13) – (3.15) показывает, что основной эффект избытка иона - осадителя заключается в резком понижении растворимости малорастворимого соединения (осадка).
. Анализ уравнений (3.13) – (3.15) показывает, что основной эффект избытка иона - осадителя заключается в резком понижении растворимости малорастворимого соединения (осадка).
Рассмотрим это на примере определения Ba2+ при осаждении BaSO4 в присутствии избытка H2SO4. Рассчитаем, во сколько раз уменьшится растворимость осадка BaSO4 в 0.1 М H2SO4 по сравнению с растворимостью в воде (без учета побочных процессов, в частности, – протонирования).
 , следовательно его растворимость в чистой воде составляет
, следовательно его растворимость в чистой воде составляет 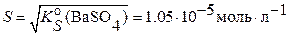 .Это намного меньше, чем
.Это намного меньше, чем
с (H2SO4) = 1·10–1 моль∙л–1, то есть условие 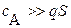 выполнено. Следовательно, согласно формуле (4.4а),
выполнено. Следовательно, согласно формуле (4.4а), 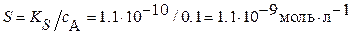 , что в тысячу раз меньше максимально допустимой растворимости
, что в тысячу раз меньше максимально допустимой растворимости
S ≤ 1·10–6 моль∙л–1. Таким образом, в присутствии избытка иона ─ осадителя реализуются необходимые условия количественного осаждения малорастворимого соединения.
Исходя из формул (3.13) и (3.15), можно рассчитать, что в случае бинарных малорастворимых соединений, у которых стехиометрические коэффициенты
p = q = 1 (в отсутствие посторонних электролитов и побочных процессов) при значениях 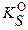 °≤ 1·10–8 для количественного осаждения малорастворимого соединения достаточен уже 50% ‑ ный избыток иона - осадителя по сравнению со стехиометрическим. При этом потери за счет растворимости осадка будут сопоставимы с чувствительностью аналитических весов. Поэтому в гравиметрическом
°≤ 1·10–8 для количественного осаждения малорастворимого соединения достаточен уже 50% ‑ ный избыток иона - осадителя по сравнению со стехиометрическим. При этом потери за счет растворимости осадка будут сопоставимы с чувствительностью аналитических весов. Поэтому в гравиметрическом
анализе для уменьшения потерь от растворимости осадка употребляют обыч-
но 50–100% ‑ ный избыток осадителя по сравнению со стехиометрией, то есть берут его в 1.5–2 раза больше, чем вычислено по уравнению реакции.
Так, если для осаждения PbSO4 из 0.01 М раствора Pb(NO3)2 прибавить рав-
ный объем 0.02 М раствора K2SO4, т.е. 100% избыток по сравнению со стехио-
метрическим соотношением, то после выделения осадка PbSO4 концентрация
иона [Pb2+ ] (остаточная концентрация), согласно формуле (4.4а), будет равна
Таблица 3.3 – Растворимость малорастворимого соединения в присутствии
избытка:
аниона при осаждении катиона катиона при осаждении аниона
| равновесные концентрации ионов | |
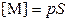 ; ; 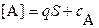
|  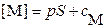
|
| уравнение произведения растворимости | |
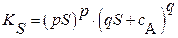 (3.11a) (3.11a)
| 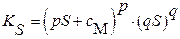 (3.11б) (3.11б)
|
| концентрации осадителей выбирают с расчетом, чтобы соблюдалось соотношение | |
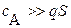
| 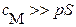
|
| тогда | |
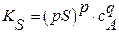 (3.12a) (3.12a) 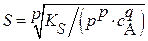 (3.13a) (3.13a)
| 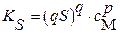 (3.12б) (3.12б) 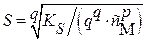 (3.13б) (3.13б)
|
| Для бинарных соединений типа BaSO4, AgCl со стехиометрическими коэффициентами: р = q = 1 | |
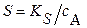 (3.14a) (3.14a)
| 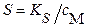 (3.14б) (3.14б)
|
| и масса растворенной части осадка | |
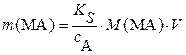 , г (3.15a) , г (3.15a)
| 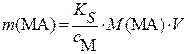 , г (3.15б) , г (3.15б)
|
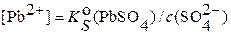 ;
; 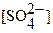 =1,6·10–8 / 1·10–2 = 1.6·10–6 моль∙л−1 или (в расчете на 0.5 л раствора), согласно формуле (3.10а), m (Pb) = [Pb2+]· M (Pb) ·V = 1.6·10–6·207.2·0.5 ≈ 1.66·10–4 г, то есть на уровне чувствительности аналитических весов. Из этого примера следует, что 50–100% ‑ ным избытком иона ‑ осадителя можно количественно (практически полно) осадить соединение МА только, когда значение
=1,6·10–8 / 1·10–2 = 1.6·10–6 моль∙л−1 или (в расчете на 0.5 л раствора), согласно формуле (3.10а), m (Pb) = [Pb2+]· M (Pb) ·V = 1.6·10–6·207.2·0.5 ≈ 1.66·10–4 г, то есть на уровне чувствительности аналитических весов. Из этого примера следует, что 50–100% ‑ ным избытком иона ‑ осадителя можно количественно (практически полно) осадить соединение МА только, когда значение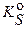 °≤ 1·10–8. Поэтому бинарные малорастворимые соединения МА, у которых
°≤ 1·10–8. Поэтому бинарные малорастворимые соединения МА, у которых 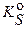 °≥ 1·10–8 , в гравиметрическом анализе в качестве осаждаемой формы, как правило, не применяются.
°≥ 1·10–8 , в гравиметрическом анализе в качестве осаждаемой формы, как правило, не применяются.
Большой избыток осадителя недопустим, так как растворимость малорастворимого соединения увеличивается в присутствии посторонних электролитов и сопряженных побочных процессов протонирования и/или комплексообразования. Например, в 1 М растворе NaCl растворимость AgCl возрастает в 8 раз по сравнению с растворимостью в насыщенном растворе за счет образования комплексных соединений типа Na[AgCl2], Na2[AgCl3], Na3[AgCl4].
Недопустимые потери могут быть обусловлены также растворимостью осадка в промывных водах при перенесении осадка на фильтр и его промывании. Если использовать в качестве промывной жидкости дистиллированную воду, то при среднем объеме 0.25 л, который требуется для промывания, например, осадка BaSO4, потеря массы за счет растворимости, согласно формуле (3.7),составит 6·10–4 г, что в шесть раз превышает допустимое значение. Следовательно, для промывания осадка BaSO4 необходимее брать не дистиллированную воду, а разбавленный раствор H2SO4.
Рассчитаем, например, какая концентрация H2SO4 должна быть в промывной жидкости, чтобы относительная погрешность потери массы, вызванная растворимостью осадка BaSO4, не превышала 0.1%. Допустим, что масса осадка BaSO4 = 0.233 г, а объем промывной жидкости V = 0.3 л. Примем насыщение раствора солью полным. Тогда допустимая потеря массы осадка за счет растворимости Δ m = 0.1·0.233 / 100 = 2.33·10–4 г. Согласно формуле (3.7), молярная концентрация 0.3 л насыщенного раствора, содержащего такое количество BaSO4, равна:
S = Δ m / [ M (BaSO4)· V ] = 2.33·10–4 / (233.4·0.3) ≈ 3.3·10–6 моль∙л−1.
В соответствии с формулой (3.11a):
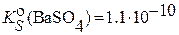 = S (S + c (
= S (S + c (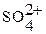 )) = 3.3·10–6∙(3.3·10–6 + c (
)) = 3.3·10–6∙(3.3·10–6 + c (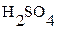 )).
)).
Согласно таблице 3.3: c (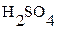 ) >>3.3·10–6. Следовательно значением 3.3·10–6 в скобке можно пренебречь и концентрация серной кислоты в промывной жидкости должна быть равна:
) >>3.3·10–6. Следовательно значением 3.3·10–6 в скобке можно пренебречь и концентрация серной кислоты в промывной жидкости должна быть равна:
c (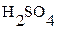 ) =
) = 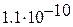 / 3.3·10–6∙ ≥ 3.3·10–5 моль∙л−1. Этот же результат можно получить сразу, воспользовавшись формулой (3.15a), так как в нашем случае m (MA) = Δ m.
/ 3.3·10–6∙ ≥ 3.3·10–5 моль∙л−1. Этот же результат можно получить сразу, воспользовавшись формулой (3.15a), так как в нашем случае m (MA) = Δ m.
|
|
Дата добавления: 2014-01-11; Просмотров: 1291; Нарушение авторских прав?; Мы поможем в написании вашей работы!