
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Струм у рідинах
|
|
|
|
Електричний струм у різних середовищах
Рідини, як і тверді тіла, можуть бути діелектриками і провідниками. До діелектриків відносять дистильовану воду, а до провідників відносяться електроліти – розчини кислот, лугів, солей, які при проходженні через них струму хімічно розпадаються. Заряди в електролітах переносяться іонами. Молекули солей, лугів і кислот складаються з двох іонів із протилежними за знаком і рівними за величиною зарядів. При їхньому розчиненні під дією електричного поля полярних молекул води відбувається розпад молекул електроліту на окремі іони. Цей процес називають електролітичною дисоціацією. Зіштовхуючись при зустрічі, іони різних знаків можуть об'єднуватись у нейтральні молекули – рекомбінувати. Звичайно ці процеси протікають одночасно, тому при незмінних умовах у розчині встановлюється динамічна рівновага, і кількість іонів у одиниці об'єму електроліту залишається сталою.
Якщо посудину із розчином електроліту включити в електричне коло, то негативні іони (аніони) почнуть рухатись до аноду (позитивного електроду, а позитивні іони (катіони) – до катоду (негативного електроду). Оскільки електричний струм у електролітах обумовлений рухом іонів, така провідність називається іонною. Закон Ома для електролітів має вигляд:
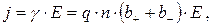 (8.25)
(8.25)
де g - провідність електроліту, b+ і b- - рухливості відповідно катіонів і аніонів, що характеризують швидкості їхнього руху, q – заряд іону, n – концентрація іонів. Слід зазначити, що провідність електролітів у багато разів менша, ніж у металів, та значно підвищується при збільшенні температури (це зв'язано із зростанням ступеня дисоціації та зниженням в'язкості електроліту).
|
|
|
При такій провідності протікання струму зв'язане із переносом речовини. На електродах відбувається виділення речовин, які входять до складу електролітів. Досягши аноду, аніони віддають йому надлишкові електрони (у хімії це називають окислювальною реакцією), які переходять у зовнішнє електричне коло і рухаються до катоду. Катіони ж на катоді здобувають відсутні електрони (відновна реакція). У результаті цих процесів аніони та катіони стають нейтральними молекулами (атомами). Процес виділення на електродах речовин, зв'язаний із окислювально-відновними реакціями, називають електролізом. У результаті електролізу, поблизу електродів відбувається накопичення продуктів хімічного розпаду електролітів. Це явище широко використовується у техніці:
А) для одержання чистих металів із розплавів та рафінування;
Б) гальваностегії – покриття металевих виробів шаром іншого металу (наприклад, нікелювання, хромування);
В) гальванопластики – виготовлення рельєфних металевих копій;
Г) електролітичного полірування поверхонь.
Вивчаючи явища, які відбуваються при протіканні струму через електроліти, англійський фізик М.Фарадей експериментально установив два основних закони електролізу. Перший закон Фарадея: маса речовини, що виділилась при електролізі на кожному із електродів, прямо пропорційна кількості електрики, яка прошла через електроліт:
m=K×q, (8.26)
де коефіцієнт K називають електрохімічним еквівалентомречовини, який дорівнює масі даної речовини, що виділилась на електроді при проходженні через електроліт заряду у 1 Кулон. Якщо струм сталий, то q=I×t, отже m=K×I×t.
Другий закон Фарадея: електрохімічні еквіваленти різних речовин пропорційні їхнім хімічним еквівалентам:
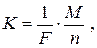 (8.27)
(8.27)
де 1 /F – коефіцієнт пропорційності, однаковий для всіх речовин. Величина F = =9,65×104 Кл/моль знайдена із досліду, називається сталою Фарадея і дорівнює добутку елементарного заряду на число Авогадро F=e×NA. Відношення молярної маси речовини до її валентності М/n називають хімічним еквівалентом речовини. Обидва закони Фарадея можна об'єднати, підставивши значення К у перший закон:
|
|
|
 (8.28)
(8.28)
Знаючи число Авогадро і сталу Фарадея, у 1874 році вперше було отримане значення елементарного електричного заряду (модуль заряду електрона) е =1,6×10-19 Кл.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1286; Нарушение авторских прав?; Мы поможем в написании вашей работы!