
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика углерода
|
|
|
|
Химическая активность
Сравнительная характеристика
СН4 SiH4 GeH4 SnH4 PbH4
метан силан герман станнан не получен

Прочность молекул ↓
Химическая активность ↑
Восстановительная способность ↑
Метан химически малоактивен, остальные гидриды очень реакционноспособны, они полностью разлагаются водой с выделением водорода:
ЭH4 + 2H2O = ЭO2 + 4H2↑
или
ЭH4 + 6H2O = H2[Э(OH)6] + 4H2↑
Углерод с водородом, кроме СН4, образует бесчисленное множество соединений CxHy – углеводородов (предмет изучения органической химии).
Получены также кремневодороды и германоводороды общей формулы ЭnH2n+2, где n≤8. Практического значения не имеют.
По значимости два элемента главной подгруппы IV группы занимают особое положение. Углерод является основой органических соединений, следовательно – главным элементом живой материи. Кремний – главный элемент всей неживой природы.
Углерод не принадлежит к самым распространенным в природе элементам – на его долю приходится 0,15 % от общего числа атомов земной коры. Формы нахождения углерода в природе многообразны. Кроме тканей всех живых организмов и продуктов их разрушения, он находится в составе карбонатных минералов (прежде всего CaCO3 и MgCO3), каменного угля, нефти, а также в виде графита и реже алмаза. Атмосфера содержит углерод в виде углекислого газа, который в растворенном состоянии находится также во всех природных водах. Углерод – главная составная часть животного и растительного мира.
Углерод – типичный неметаллический элемент, относящийся к р-элементам IV группы. В зависимости от числа σ-связей координационное число углерода равно четырем (sp3-гибридизация), трем (sp2-гибридизация) или двум (sp-гибридизация валентных орбиталей):
|
|
|
| Характер гибридизации орбиталей атома углерода | Пространственное расположение σ-связей | Примеры соединений |
| sp3 sp2 sp | Тетраэдрическое Треугольное Линейное | Алмаз, CH4 Графит, C6H6 Карбин, CO2 |
В большинстве неорганических соединений углерод проявляет степени окисления – 4; + 4; + 2. В атоме углерода число валентных электронов равно числу валентных орбиталей. Это одна из основных причин большой устойчивости связи С-С и исключительной склонности углерода к образованию гомоцепей. Гомоцепные молекулы, содержащие связь С-С, бывают самых разнообразных типов: линейные, разветвленные, сшитые и циклические. В зависимости от этого мы можем выделить три аллотропные модификации углерода – алмаз, графит и карбин.
Алмаз – бесцветное кристаллическое вещество с атомной координационной кубической решеткой (рис. 1).

Рис. 1. Схема расположения атомов углерода в алмазе
Каждый атом в алмазе образует равноценные прочные σ-связи с четырьмя соседними. Это обуславливает исключительную твердость и отсутствие электронной проводимости в обычных условиях.
Графит – слоистое кристаллическое вещество с гексагональной структурой, серого цвета и металлическим блеском. В соответствии с sp2-гибридизацией орбиталей атомы углерода объединяются в макромолекулы, представляющие собой бесконечные слои из шестичленных колец (рис. 2).
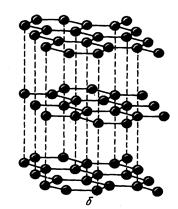
Рис. 2. Структура графита
Прочность химических связей в плоскости макромолекулы значительно больше, чем между слоями. Поэтому графит довольно мягок, легко расслаивается, химически несколько активнее алмаза.
Карбин – черный порошок; его решетка гексагональная, построена из прямолинейных цепочек. sp-гибридизация орбиталей углерода отвечает объединению атомов в цепи вида:
-С≡С-С≡С-С≡ (полиин)
или
=С=С=С=С=С (поликумулен).
Карбин – полупроводник. Под влиянием света его электрическая проводимость резко возрастает.
|
|
|
Сочетание атомов углерода разных гибридных состояний в единой полимерной структуре порождает множество аморфных форм углерода. Типичным примером аморфного углерода является стеклоуглерод и фуллерен, кокс, древесный уголь и сажа.
Уголь (особенно древесный) обладает большой адсорбционной способностью (т. е. поглощением на поверхности газов, паров и растворенных веществ). Такая способность угля обусловливается его пористостью. Чем больше пор, тем больше поверхность угля и тем больше адсорбционная способность. Обычно поры древесного угля частично заполнены различными веществами, что снижает его адсорбционную способность. Для усиления адсорбции уголь подвергают специальной обработке – нагревают в струе водяного пара, чтобы освободить его поры от загрязняющих веществ. Обработанный таким образом уголь называют активным. В медицине таблетки из активного угля используют для удаления вредных веществ из организма.
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 1536; Нарушение авторских прав?; Мы поможем в написании вашей работы!