
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства углерода
|
|
|
|
 Обе модификации углерода (алмаз и графит) химически весьма инертны. Мелкокристаллические формы графита – кокс, сажа, активированный уголь – более реакционноспособны, но, как правило, после их предварительного нагревания до высокой температуры. Углерод проявляет восстановительные свойства.
Обе модификации углерода (алмаз и графит) химически весьма инертны. Мелкокристаллические формы графита – кокс, сажа, активированный уголь – более реакционноспособны, но, как правило, после их предварительного нагревания до высокой температуры. Углерод проявляет восстановительные свойства.
1) Реакции с более электроотрицательными неметаллами
а) Взаимодействие с кислородом
С(графит) + О2 (г) ═ СО2 (г)
2С + О2 = 2СО
Сжигание угля – один из важнейших источников энергии.
б) Взаимодействие с фтором и серой
С + 2F2 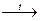 CF4 тетрафторид углерода
CF4 тетрафторид углерода
C + 2S 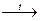 CS2 сероуглерод
CS2 сероуглерод
2) Реакции с оксидами металлов (карботермия)
Кокс – один из важнейших восстановителей, используемых в промышленности. В металлургии с его помощью получают металлы из их оксидов, например:
2С + Fe2O3 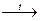 2Fe + 3CO
2Fe + 3CO
При взаимодействии углерода с оксидами щелочных и щелочноземельных металлов восстановленный металл, соединяясь с углеродом, образует карбид. Например:
3C + CaO 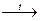 CaC2 + CO
CaC2 + CO
3) Реакции с кремнеземом
Кокс применяется также для получения кремния:
2С + SiO2 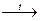 Si + 2CO
Si + 2CO
При избытке кокса образуется карбид кремния (карборунд) SiC.
4) Получение «водяного газа» (газификация твердого топлива)
Пропусканием водяного пара через раскаленный уголь получают горючую смесь СО и Н2, называемую водяным газом:
С + Н2О 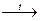 СО + Н2
СО + Н2
5) Реакции с окисляющими кислотами
Активированный или древесный уголь при нагревании восстанавливает анионы NO3- и SO42- из концентрированных кислот:
C + 4HNO3 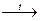 CO2↑ + 4NO2↑ + 2H2O
CO2↑ + 4NO2↑ + 2H2O
C + 2H2SO4 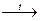 CO2↑ + 2SO2↑ + 2H2O
CO2↑ + 2SO2↑ + 2H2O
6) Реакции с расплавленными нитратами щелочных металлов
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает с образованием ослепительного пламени:
5C + 4KNO3 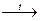 2K2CO3 + 3CO2↑ + 2N2↑
2K2CO3 + 3CO2↑ + 2N2↑
|
|
|
7) С – малоактивный окислитель:
С0 + 4ē → С-4
Образование солеобразных карбидов с активными металлами.
Значительное ослабление неметаллических свойств у углерода выражается в том, что функции его как окислителя проявляются в гораздо меньшей степени, чем восстановительные функции.
Только в реакциях с активными металлами атомы углерода переходят в отрицательно заряженные ионы С-4 и (С≡С)2-, образуя солеобразные карбиды:
3С + 4Al 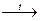 Al4C3 карбид алюминия
Al4C3 карбид алюминия
2C + Ca 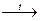 CaC2 карбид кальция
CaC2 карбид кальция
Карбиды ионного типа – очень нестойкие соединения, они легко разлагаются под действием кислот и воды, что свидетельствует о неустойчивости отрицательно заряженных анионов углерода:
Al4C3 + 12H2O = 3CH4↑ + 4Al(OH)3
CaC2 + 2H2O = C2H2↑ + Ca(OH)2
8) Образование ковалентных соединений с металлами
В расплавах смесей углерода с переходными металлами образуются карбиды преимущественно с ковалентным типом связи. Молекулы их имеют переменный состав, а вещества в целом близки к сплавам. Такие карбиды отличаются высокой устойчивостью, они химически инертны по отношению к воде, кислотам, щелочам и многим другим реагентам.
9) Взаимодействие с водородом
При высоких температуре и давлении, в присутствии никелевого катализатора, углерод соединяется с водородом:
С + 2H2  CH4
CH4
|
|
|
|
|
Дата добавления: 2014-10-15; Просмотров: 994; Нарушение авторских прав?; Мы поможем в написании вашей работы!