
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
D-элементы
|
|
|
|
268. Какую степень окисления проявляют d-элементы V группы? Какова их реакционная способность? Приведите уравнения соответствующих реакций с кислородом, серой, галогенами, азотом при нагревании.
269. Руководствуясь учебной литературой, установите какие из металлов
I-Б группы и в каких условиях реагируют с: кислородом, галогенами, серой. Напишите уравнения соответствующих реакций.
270. Какие химические свойства соединений меди(II) проявляются в реакциях? Предложите способы переведения в раствор образующихся осадков:
CuSO4 + H2S = CuBr2 + H2O + SO2 =
Cu(CH3COO)2 + H2O + N2H4×H2O =
271. Предложите возможно большее число реакций восстановления оксида меди(II): а) водородом; б) углеродом. Укажите условия протекания реакций.
272. Рассмотрите уравнения реакций, протекающих в жидком аммиаке:
AgNO3 + KNH2(нед.) = AgNH2 + KNO3
AgNO3 + 2KNH2(изб.) = K[Ag(NH2)2] + KNO3
Какие свойства соединений серебра(I) проявляются в этих реакциях? Какие аналогичные реакции протекают в водном растворе с участием соединений алюминия или цинка?
273. Как изменяется реакционная способность в ряду хром-молибден-вольфрам? Как перевести эти металлы в растворимое состояние?
Э + NaOH + NaNO3 ® Na2ЭО4 + NaNO2 + H2
(Э = Мо; W)
W + HNO3 + HF = H2[WF8] + NO + H2O
274. Какими свойствами обладают оксиды и гидроксиды хрома с различными степенями окисления? Дать пояснения и привести уравнения соответствующих реакций.
275. Как экспериментально доказать амфотерные свойства гидроксида хрома(III)? Какие свойства проявляют соли хрома(III)? Привести уравнения соответствующих реакций.
276. Докажите восстановительные свойства солей хрома(III). Какие типы комплексных соединений характерны для хрома(III)?
277. Какова биологическая роль d-элементов VI группы, какие соединения этих элементов находят применение в медицине и фармации?
278. Сравните свойства d-элементов VII-группы? При ответе используйте электронные формулы атомов:
Ra, 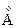 Iион c.о.
Iион c.о.
Mn …3d54s2 1,30 7,43 +2, +3, +4, +6, +7
Tc …4d55s2 1,36 7,28 +4, +6, +7
Re …4f145s25p65d56s2 1,37 7,87 +3, +4, +6, +7
279. Какие соединения образует Mn(II)? Какие свойства для них характерны? Приведите уравнения соответствующих реакций.
280. Какие свойства проявляют соединения марганца(III)? Приведите уравнения соответствующих реакций?
281. Какие свойства в окислительно-восстановительных и обменных реакциях проявляет диоксид марганца(IV). Приведите соответствующие реакции. Напишите реакцию гидролиза манганита калия (K2MnO3). Приведите формулы природных соединений марганца.
282. Как получаются манганаты? Какие свойства проявляют соединения марганца(VI) в окислительно-восстановительных реакциях?
283. Охарактеризуйте окислительные свойства перманганата калия на основании стандартных электродных потенциалов. Приведите уравнения реакций.
jо(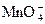 + 2H2O + 3e = MnO2 + 4OH–) = +0,60 B
+ 2H2O + 3e = MnO2 + 4OH–) = +0,60 B
jо(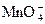 + е =
+ е = 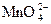 ) = +0,56 В
) = +0,56 В
jо(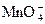 + 8H+ + 5e = Mn2+ + 4Н2О) = +1,51 B
+ 8H+ + 5e = Mn2+ + 4Н2О) = +1,51 B
284. Какова устойчивость соединений марганца(VII). Приведите реакции термического разложения KMnO4, а также обсудите окислительно-восстановительные свойства KMnO4 в различных средах.
285. Как изменяются кислотно-основные свойства гидроксидов марганца в зависимости от степени окисления элемента? Приведите примеры и соответствующие уравнения реакций.
286. Какая химическая активность металлов семейства железа?
jо(Fe2+/Fe) = –0,44 B jо(Fe3+/Fe) = –0,04 B jо(Со2+/Со) = –0,28 B jо(Ni2+/Ni) = –0,025 B
Ответ поясните. Приведите уравнения соответствующих реакций.
287. Какие оксиды и гидроксиды образуют железо? Какие свойства для них характерны. Дайте подробный ответ и приведите уравнения соответствующих реакций.
288. Как изменяются окислительно-восстановительные свойства гидроксидов в ряду железо-кобальт-никель? Ответ поясните, приведите уравнения соответствующих реакций.
289. Какие комплексные соединения образует железо. Приведите качественные реакции на ионы Fe+2, Fe+3.
290. Какие комплексные соединения образуют кобальт и никель? Приведите качественные реакции определения иона Ni+2.
291. Биологическая роль соединений d-элементов VII и VIII групп и применение их соединений в медицине и фармации.
292. Какую роль играют в живых организмах d-элементы VIII группы?
293. В виде каких соединений железо и кобальт применяют в качестве лекарственных средств?
294. Как применяют в медицине платиновые металлы?
295. Почему гидроксиды железа(III) и кобальта(III) по-разному взаимодействуют c соляной и серной кислотами? Напишите уравнения соответствующих реакций. Ответ поясните.
296. Как изменяется химическая активность в ряду Cu–Ag–Au? Какую роль играют в живых организмах d-элементы I и II групп.
Список литературы
1. Глинка Н.Л. Общая химия. Л.: Химия. 1987, –704 с.
2. Общая химия. Биофизическая химия. Химия биогенных элементов.
Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова – М.: Высшая школа, 1993, –560 с.
3. Химия: Основы химии живого. Учебник для вузов. – СПб: Химиздат, 2000, –768 с.
4. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1981, –520 с.
5. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 1975, 1981, 1987, –469 с.
6. Глинка Н.А. Задачи и упражнения по общей химии. –Л.: Химия, 1986, –264 с.
7. Гольбрайх, Е.И. Маслов. Сборник задач и упражений по химии. –М.: Высшая школа, 1997, –384 с.
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!