
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
СОЕДИНЕНИЯ Si
|
|
|
|
КРЕМНИЙ Si
| В природе:в виде оксидаSiO2 и солей кремниевой кислоты – силикатов, NaAlSi3O8 – полевой шпат, Al2O3·SiO2·nH2O – глины. |
| Аллотропные модификации Si | |
| Алмазоподобная структура sp3-гибридизация. Металлический блеск, электропроводен, инертен. | Аморфный кремний Бурый порошок, более реакционноспособный. |
| Получение Si | |
| В лаборатории: 2Mg + SiO2 = 2MgO + Si SiCl4 + 2Zn = 2ZnCl2 + Si В промышленности: SiO2 + С = СО2 + Si |
| Химические свойства |
| Si – сравнительно инертен, реагирует с сильными окислителями или восстановителями. Как правило, требуется высокая температура. Si – восстановитель 1) 4F + Si = SiF4↑ (фторид кремния) t комнатная 2) O2 + Si = SiO2 при нагревании 3) 2Cl2 + Si = SiCl4 t = 400-600˚C 4) 2NaOH + H2O + Si = Na2SiO3 + 2H2↑ 5) C + Si = SiC (карбид кремния) Si – окислитель 6) 2Сa + Si = Ca2Si (силицид кальция) |
Оксид кремния SiO2– инертен, твердое вещество, тугоплавкое.
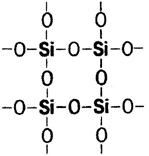 4HF + SiO2 = SiF4↑ + 2H2O (травление стекла)
SiO2 – кислотный оксид
SiO2 + 2NaOH = Na2SiO3 + H2О
SiO2 + СaO = CaSiO3
SiO2 + Na2CO3 4HF + SiO2 = SiF4↑ + 2H2O (травление стекла)
SiO2 – кислотный оксид
SiO2 + 2NaOH = Na2SiO3 + H2О
SiO2 + СaO = CaSiO3
SiO2 + Na2CO3 Na2SiO3 + CO2 Na2SiO3 + CO2
| ||
Кремниевая кислота: H4SiO4– ортокремниевая
H2SiO3– метакремниевая
H2SiO3 – очень слабая кислота, в воде мало растворима.
H2SiO3 = H2O + SiO2 (при нагревании)
H2SiO3 ↔ H+ + HSiO-3
|
| Соли кремниевой кислоты – силикаты Соли Na и К растворимы в воде – жидкие стекла Сильный гидролиз 2Na2SiO3 + 2H2О = Na2Si2O5 + 2NaOH метосиликат Na диметосиликат Na |
| Получение солей:SiO2 + Na2CO3 = Na2SiO3 + CO2; SiO2 + 2NaOH = Na2SiO3 + H2O. |
| Важнейшие искусственные силикаты | ||
| Стекло | Цемент | Керамика |
| Na2O·CaO·6SiO2– обычное стекло. Получают плавлением из смеси Na2CO3 (сода), CaCO3 (известняк), SiO2 (белый песок) 1) SiO2+Na2CO3=Na2SiO3+CO2↑ 2) SiO2+CaCO3=CaSiO3+CO2↑ 3) Na2SiO3+CaSiO3+4SiO2= =Na2O·CaO·6SiO2 K2CO3 (поташ)+CaSiO3+SiO2 – тугоплавкое стекло K2CO3+PbO+SiO2 – хрусталь | Серый порошок, при смешивании с водой затвердевает. Получают обжигом (1600˚С) до спекания смеси известняка, глины (клинкер) и добавок, размалывают в порошок. Цемент + вода + наполнитель (песок) = бетон | Получают из природных глин путем формовки, сушки и обжига. |
|
|
|
Элементы VА группы
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1178; Нарушение авторских прав?; Мы поможем в написании вашей работы!
