
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролизер 2 страница
|
|
|
|
Атом қозған жағдайдан 10-9 – 10-7 секунд аралығында қалыпты жағдайға ауысады. Бұл кезде ол фотон немесе жылу шығарады. Жылу шығарған кезде сәуле шығармайды, бұл суретте ирек сызықпен көрсетілген.
Шығарылатын немесе жұтылатын сәуленің жиілігі электрондық орбитальдар арасындағы энергия айырымымен 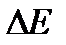 анықталады:
анықталады:
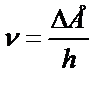 .
.
Кванттық жағдайдың абсолютті энергиясы белгісіз, оны иондану энергиясын (электронның атомнан толық бөлінуіне сәйкес болатын) шартты түрде нөлге тең деп алып, сол бойынша есептейді.
Атомдық орбитальдар энергиясы бір-бірінен өзгеше болады. Мысалы, орбитальда ядроға жақын орналасқан (негізгі квант саны n=1 болатын) электронды қоздыру үшін 6.104 кДж. моль-1 қажет (шығарылатын фотондар рентген сәулелерінің жиілігіне ие болады), ал сыртқы электрондарды қоздыру үшін 150-600 кДж.моль-1 энергия жеткілікті болады (ультракүлгін және көрінетін сәулелер). Негізгі квант санының өсуіне байланысты қоздыру энергиясы 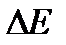 және сәулелену жиілігі азаяды (14.6-сурет).
және сәулелену жиілігі азаяды (14.6-сурет).
| 4d |
| 5s |
| 4s |
| 3s |
| 2s |
| 1s |
| 4p |
| 3p |
| 2p |
| 3d |
| ∆E |
| ∆E |
| ∆E |
| Көрінетін аудан |
| Алыс УФ аудан |
| Рентген аудан |
14.6-сурет. Әртүрлі кванттық күйдегі энергетикалық деңгейлердің салыстырмалы орналасуы және электрондық ауысулар кезінде энергияның өзгеруі.
Ең мүмкін болатын ауысу бірінші қозған деңгейден қалыпты жағдайға Е0 ауысу болып табылады, оған сәйкес спектральды сызықтар резонансты сызықтар деп аталады. Электронның одан жоғары энергетикалық деңгейлерге (Е2, Е3 және т.б.) ауысуы мүмкін. Бұл кезде оның қалыпты жағдайға ауысуы әртүрлі аралық деңгейлер арқылы жүзеге асуы мүмкін.
|
|
|
Сыртқы оңай қозатын электрондарды оптикалық электрондар деп атайды, олардың қатысуымен болатын ауысулар оптикалық спектр береді. Әртүрлі элементтердің сыртқы электрондарының қозу энергиялары әртүрлі болады. Мысалы, сілтілі металдардың резонансты сызықтарын (Е1→ Е0) алу үшін салыстырмалы түрде аз энергия қажет (~ 2эВ, толқын ұзындығы көрінетін ауданда жатады), металеместер үшін энергия мейлінше үлкен болады (~ 5эВ, толқын ұзындығы УК ауданда жатады). Сыртқы валенттік электрондары көп болған сайын атомның энергетикалық ауысуларға мүмкіндігі жоғары болады, сондықтан металл спектрлері, мысалы темірдің спектрі мыңдаған сызықтардан тұрады, ал сілтілі металдардың спектрлерінде керісінше, сызықтар саны өте аз болады.
 Оптикалық ауысулардың барлығы бірдей мүмкін бола бермейді. Мүмкіндігі жоғары ауысулар – рұқсат етілген, ауысу мүмкіндігі төмендер – тиым салынған деп аталады. Мысалы, бір электроннан көбірек электронның ауысуына тиым салынған түріне, сонымен қатар спинін өзгертіп ауысуға және қосымша квант санын 1 бірліктен жоғары мәнге өзгертуге тиым салынған түріне жатады. Яғни, s – p – орбитальға, p – d – орбитальға ауысуға рұқсат етілген, ал s – d – орбитальға немесе p – f орбитальға тиым салынған түріне жатады.
Оптикалық ауысулардың барлығы бірдей мүмкін бола бермейді. Мүмкіндігі жоғары ауысулар – рұқсат етілген, ауысу мүмкіндігі төмендер – тиым салынған деп аталады. Мысалы, бір электроннан көбірек электронның ауысуына тиым салынған түріне, сонымен қатар спинін өзгертіп ауысуға және қосымша квант санын 1 бірліктен жоғары мәнге өзгертуге тиым салынған түріне жатады. Яғни, s – p – орбитальға, p – d – орбитальға ауысуға рұқсат етілген, ал s – d – орбитальға немесе p – f орбитальға тиым салынған түріне жатады.
Спектрдегі сызықтар көптеген бірдей атомдардың әртүрлі ауысуларымен байланысты болады. Белгілі бір уақыт аралығында зат энергиясы рұқсат етілген ауысудан көп фотон жұтады және энергиясы тиым салынған ауысудан аздаған фотонды жұтады не шығарады. Сызықтың қанықтығы 1 секундтағы фотон санына пропоционалды болады, сондықтан жиі кездесетін ауысуға қанық сызықтар сәйкес келеді де, ал сирек кездесетін ауысуға қанықтығы төмен сызықтар сәйкес болады. Резонансты сызықтар қанығырақ болады, өйткені Е1→ Е0 ауысуларының ықтималдығы жоғары.
|
|
|
Сәуле шығару өз бетінше болатын процесс, өйткені атом қашанда тұрақсыз қозған жағдайдан одан тұрақтырақ, яғни энергетикалық төмен деңгейге ауысуға ұмтылады. Керісінше жарық жұту – мәжбүр болатын процесс, яғни атом энергиясын жұтылатын фотон арқылы арттыру процесі.
Егер атомға жоғары энергия берсе (103-105 эВ) мысалы затты өте жылдам, электрондар немесе рентген сәулелері арқылы қоздыру арқылы, онда ішкі электрондар қозуы мүмкін немесе осы электрондардың K, L орбитальдарынан шығып кетуі де мүмкін. Бұл кезде босаған орынға алысырақ орбитальда орналасқан электрон ауыса алады: L – ден K- ға, М –нен L- ға, М –нен K- орбиталына. Бұл кезде рентген сәулесінің кванты бөлінеді.
Атомды-спектроскопиялық анализ әдісі. Жоғарыда келтірілген ауысулар аналитикалық мақсаттарда қолданылады. Зат атомының энергетикалық жағдайын өзгертуге негізделген әдістер атомды-спектроскопиялық анализ әдістеріне жатады. Олар сигналды алу және тіркеу тәсілдеріне байланысты өзгешеленеді.
Оптикалық әдістер сыртқы валенттілік электрондарының энергетикалық ауысуларын қолданады. Бұл әдіске затты алдын ала атомдардарға ыдыратып алу қажеттігі тән. Атомды-эмиссионды спектрометрия атомдардың сәуле шығаруына негізделген. Бұнда атомдар плазманың кинетикалық энергиясымен, доға немесе искра разрядтарымен қоздырылады. Атомды-флуоресцентті спектроскопия атомдардың сәуле шығаруына негізделген. Атомдар сыртқы көздің электромагниттік сәулеленуі арқылы қоздырылады.
|
|
|
Атомды-абсорбциялық спектроскопия сыртқы жарық көзінен атомның сәуле жұтуы. Рентген әдістері атомның ішкі электрондарының энергетикалық ауысуына негізделген. Сигналды алу және тіркеу тәсіліне байланысты рентгенэмиссиялық, рентгенабсорбциялық және рентгенфлуоресцентті спектроскопия деп бөледі. Зат құрылысын зерттеу үшін осы әдістің басқа да түрлерін қолданады, мыс, оже-спектроскопия, рентгенді электрон-зондты анализ, электронды спектроскопия. Рентген әдістері алдын ала атомизациялауды қажет етпейді, бұнда қатты сынаманы алдын ала дайындамай-ақ анализдеуге болады. Ядролық әдістер – атом ядросын қоздыруға негізделген.
14.2.3. Молекула құрылысы және молекулалық спектрлердің пайда болуы
Молекулалар екі немесе одан да көп атомдардан тұрады, атомдар бір-бірімен белгілі бір бағытта және химиялық байланыстар арқылы байланысады. Бұндай байланыстар сыртқы электрондардың әсерлерінен пайда болады. Бұл кезде атомдар бір-біріне жақындайды, бірақ олардың толған қабаттары бір-бірімен жанаспайды. Атомға қарағанда молекуланың энергетикалық деңгейі күрделірек. Электрондардың қозғалысынан басқа атомдардың өздерінің, дәлірек айтқанда оның ядросының тербелісі болады және сонымен бірге молекуланың өзінің тұтас дене ретіндегі айналуы болады. Сондықтан кез келген қалыпты жағдайда молекуланың энергиясы электрондық, тербелмелі және айналмалы энергиялардың қосындысынан тұрады: Е=Еэл +Етерб.+Еайн.
Ең көп үлесті электрондар энергиясы қосса, ең аз үлесті молекуланың айналмалы энергиясы қосады: Еэл >> Етерб.>>Еайн.
Молекулалардың айналуы заттардың газ тәрізді күйлерінде ғана байқалады, сұйық және қатты, яғни кондинсирленген күйлерінде олардың айналуы қиындайды. Атом сияқты молекулада белгілі энергетикалық жағдайларда болады, оларды энергетикалық деңгейлер немесе орбитальдар дейді. Әрбір электрондық жағдайға тербелмелі деңгей, ал әрбір тербелмелі деңгейге айналмалы деңгей сәйкес келеді. Әрбір деңгей негізгі, қосымша, магнитті және спинді сандардан басқа тербелмелі және айналмалы квант сандарымен сипатталады.
|
|
|
Сырттан энергия алғанда немесе сыртқа энергия бергенде молекула бір энергетикалық деңгейден екіншісіне ауысады (14.7-сурет).
| 𝜈2 |
| 𝜈1 |
| s1 |
| 𝜈2 |
| 𝜈1 |
| s0 |
| II |
| I |
| III |
| IV |
| V |
| VI |
| VII |
| VIII |
| T1 |
14.7-сурет. Молекуладағы энергетикалық ауысулар
Молекулада да атомдағы сияқты сыртқы (оптикалық) электрондар қозуға бейім болады. Сыртқы электрондарды қоздыру энергиясының мәні де атомдардағыдай (150-600 кДж.моль-1), ол көрінетін және УК спектрлерге сәйкес болады. Бір электрондық жағдайдағы тербелмелі деңгейлер аралығындағы ауысуларға (0,4 – 150 кДж.моль-1, сеулелену ИҚ ауданда) аз энергия жұмсалады, айналмалы деңгейдегі ауысуларға одан да аз энергия (0,01-0,4 кДж.моль-1 , сәулелену қашық ИҚ және микротолқындар ауданында) жұмсалады.
Энергетикалық деңгейлер арасында негізгі квант санын өзгерте жүретін ауысулар электрондық, ал айналмалы деңгейшелер арасындағы ауысулар айналмалы деп аталады. Олардың спектрлерін де өздеріне сәйкес (электрондық, тербелмелі және айналмалы деп) атайды. Таза электрондық және тербелмелі спектрлер жоқ. Электрондық ауысу міндетті түрде тербелмелі және айналмалы жағдайлардың өзгеруі арқылы жүзеге асады, ал тербелмелі ауысу айналмалы жағдайдың өзгеруіне әкеліп соғады.
Спектроскопияда көбінесе молекуланың электромагниттік өрістің әсерінен қозуын қолданады. Бұл кезде молекула фотонды жұтады, фотонның энергиясы оның орбитальдарының энергиялар айырымына тең болады. Барлық жұтылған жиіліктер жиынтығы молекуланың жұту спектрін құрайды, оны молекулалық абсорбциялық спектр деп атайды. Заттың бұзылуына әкеліп соғатын қоздыру көздері (мысалы, плазма) қолданылмайды. Молекуланың энергетикалық жағдайының саны көп болады және жеке ауысулардың энергияларының шамалары да бір-біріне жақын болғандықтан, оларды бір-бірінен ажырату қиынға соғады. Сондықтан молекулалық спектрде спектральды сызықтар бір-бірімен қосылып, бірігіп кеткен болады да, біртұтас жұту жолағын береді.
Молекуланың қалыпты жағдайға ауысуы атомға қарағанда қиынырақ болады. Алдымен қысқа уақыт ішінде (~10-13с) молекула қозған жағдайдың негізгі деңгейіне 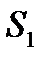 ауысады (14.7-сурет, ІІ – процесс). Бұл кезде артық энергия жылу түрінде бөлінеді. Одан әрі процесс үш түрлі жолдың біреуімен жүзеге асады: 1) сәуле шығармай, молекуланың басқа бөлшекпен соқтығысуы арқылы жылу бөлуі (ІІІ-процесс); 2) қозбаған
ауысады (14.7-сурет, ІІ – процесс). Бұл кезде артық энергия жылу түрінде бөлінеді. Одан әрі процесс үш түрлі жолдың біреуімен жүзеге асады: 1) сәуле шығармай, молекуланың басқа бөлшекпен соқтығысуы арқылы жылу бөлуі (ІІІ-процесс); 2) қозбаған  жағдайының тербелмелі деңгейлерінің біреуіне фотон шығару арқылы ауысуы (ІУ – процесс, флуоресценция); 3) триплетті қозған
жағдайының тербелмелі деңгейлерінің біреуіне фотон шығару арқылы ауысуы (ІУ – процесс, флуоресценция); 3) триплетті қозған 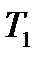 деңгейге ауысу (УІ – процесс) және одан әрі
деңгейге ауысу (УІ – процесс) және одан әрі  жағдайына жылу бөлу арқылы ауысу (УІІ-процесс) немесе фотон бөлу арқылы ауысуы (УІІІ – процесс, фосфоресценция). Флуоресценция және фосфоресценция процестерін біріктіріп люминесценция құбылысы деп атайды.
жағдайына жылу бөлу арқылы ауысу (УІІ-процесс) немесе фотон бөлу арқылы ауысуы (УІІІ – процесс, фосфоресценция). Флуоресценция және фосфоресценция процестерін біріктіріп люминесценция құбылысы деп атайды.
Молекулада да атомдағы сияқты барлық энергетикалық өзгерістер мүмкін бола бермейді. Мысалы, бір актіде бір электронның ауысуына тиым салынған, қосымша квант санын бірден жоғары бірлікке өзгертіп ауысуға және спин санын өзгертіп ауысуға тиым салынған.
Фотондарды жұту мүмкіншілігі жұту жолағының спектральды сызықтарының қанықтығын анықтайды. Жолақтың максимумы қанықтығы ең жоғары сызыққа сәйкес келеді.
Молекулалық-спектроскопиялық анализ әдісі. Аналитикалық сигналдың шығу тегіне байланысты молекулалық-спектроскопиялық әдістерді бірнеше түрге бөледі:
1. Абсорбциялық молекулалық спектроскопия валенттілік электрондарының энергетикалық ауысуына негізделген, олардың сигналдары көрінетін және УК аудандарда байқалады. Молекуланың көрінетін және УК сәулелерді жұтуына негізделген аналитикалық әдістерді спектрофотометриялық және фотометриялық әдістер деп атайды.
2. Абсорбциялық молекулалық спектрометрия (инфрақызыл спектрометрия) – бұл тербемелі ауысуларға негізделген, олардың сигналдары ИҚ ауданда байқалады. ИҚ спектрометрия – бұл қосылыстарды идентификациялау мен молекула құрылысын зерттеудің ең тиімді жолы.
3. Люминесцентті спектрометрия қозған молекуланың жарықты шығаруына негізделген әдіс. Егер энергетикалық ауысу электронның спин санын өзгертпей жүзеге асатын болса әдіс флуоресцентті спектрометрия деп аталады, ал егер энергетикалық ауысу электронның спин санын өзгертіп жүзеге асатын болса оны фосфоресцентті спектрометрия деп атайды.
4. Магнитті резонансты спектроскопия магнитті өріске орналастырылған молекуладан сигнал алуға негізделген әдіс.
5. Фотоакустикалық спектроскопия – бұл әдіс сәуле шығармайтын ауысулардағы жылуды өлшеуге негізделген.
6. Рентгенді спектроскопия молекуланың ішкі электрондарын қоздыруға негізделген әдіс.
14.2.4 Жарық жұтудың негізгі заңы
Әрбір біртектес система жарықтың белгілі толқын ұзындығын сіңіреді. Яғни ерітінділер әр түсті болғандықтан, жарықты таңдамалы жұтады. Мысалы, ерітінді жасыл түсті болса өз бойынан жасыл жарық спектрін өткізіп, қалған спектрлерді жұтады.
Жарық энергиясының белгілі мөлшерін жұтқан молекула өзінің минималды энергиясы бар негізгі жағдайынан (E1) жоғарғы энергиялық жағдайына Е2-ге ауысады.
Система біртектес болса жұтылған энергияның мөлшері энергияны сіңіретін заттың концентрациясына тура пропорционалды болады:
M+hn=M*
Бұндағы: М* – жоғарғы энергиялы мөлекула тұрақтылығы 10–8 – 10–9с;
h – Планк тұрақтысы;
n – жұтылған жарықтың жиілігі;
n=c/l – бұндағы с – жарықтың таралу жылдамдығы;
l – толқын ұзындығы.
М* – молекуласы өте тұрақсыз және бөлініп шығатын жылудың мөлшері де аз болғандықтан ерітіндіде ешқандай сыртқы өзгеріс байқалмайды.
Фотометриялық анализ 2-сатыдан тұрады:
1) Анықтайтын заттың түсті ерітіндісін алу. Ол үшін бейорганикалық немесе органикалық реагентпен комплекс түзу немесе тотығу-тотықсыздану реакциясын (мысалы: Cr →Cr2O72-; Mn(II) →MnO4-) қолданады.
2) Боялған қосылыс, дәлірек айтқанда боялған ерітінді жұтқан жарықтың мөлшерін өлшеу.
Жұтылатын жарықтың мөлшері боялған ерітіндінің қалыңдығына тікелей байланысты болады.
Интенсивтігі I0 жарық шоғы боялған ерітіндінің қабатынан өткенде, оның белгілі мөлшері жұтылады, екінші бөлігі шағылады және үшіншісі таралады. Осыған байланысты жарық ерітіндіден әлсіреп өтеді. Өткен жарықтың интенсивтігін I десек, онда I0>I болады. Жарықтың жұтылуын салыстырып өлшегенде оның таралатын және шағылатын мөлшерлерін ескермеуге болады. Жарық шоқтарының интенсивтігі арасындағы байланыс Бугер-Ламберт заңымен анықталады. Бұл заң бойынша белгілі заттың біртектес қабаты жарықтың белгілі бөлігін жұтады. Қабаттарының қалыңдығы бірдей заттар жарықтың бірдей үлесін, яғни мөлшерін жұтады. Жұтылған жарықтың үлесі түскен жарықтың интенсивтігіне байланысты емес. Мысалы, төртбұрышты кюветаны тең қабаттарға бөлсек, әр қабат жұтатын жарықтың үлесі бірдей болады.
Жарық бірінші қабаттан өткенде n есе әлсірейді. 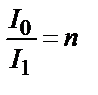 ;
; 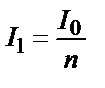
Бірінші қабаттан өткен жарық I1 екінші қабатқа түседі де, қалыңдығы бірдей болғандықтан, ол да n есе әлсіреп өтеді:
 ;
; 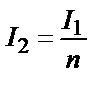 . Енді I1 орнына оның өз мәнін қойсақ:
. Енді I1 орнына оның өз мәнін қойсақ: 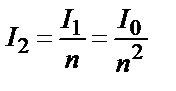 .
.
Сол сияқты 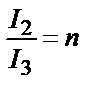 ;
; 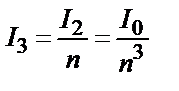 .
.
Қалыңдығы l қабаттан өткен жарықтың I мөлшері: 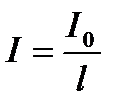 ;
; 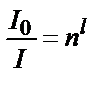 ;
; 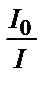 қатынасының ондық логарифмі ерітіндінің оптикалық тығыздығы деп аталады, ол А(D) белгіленеді:
қатынасының ондық логарифмі ерітіндінің оптикалық тығыздығы деп аталады, ол А(D) белгіленеді: 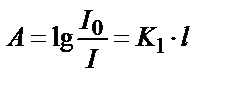 . Ламберт-Бугер заңы бойынша жарықтың жұтылған мөлшері боялған ерітіндінің қалыңдығына тікелей байланысты.
. Ламберт-Бугер заңы бойынша жарықтың жұтылған мөлшері боялған ерітіндінің қалыңдығына тікелей байланысты.
Жоғарыда айтылған тәсіл Ламберт-Бугер заңын геометриялық жолмен қорытып шығару әдісі. Математикалық жолмен Ламберт-Бугер заңы экспоненциалды байланысты көрсететін теңдікпен өрнектеледі:
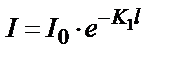 (14.1)
(14.1)
е – натурал логарифмнің негізі;
К1 – жұтылу коэффициенті;
l – жарық жұтатын қабаттың қалыңдығы;
I/ I0 – қатынасын өткізгіштік деп атайды да Т деп белгілейді.
(1) – теңдіктің логарифмді түрін жазсақ: 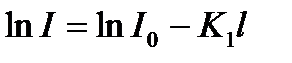 . Енді натурал логарифмді ондық логарифмге айналдырсақ:
. Енді натурал логарифмді ондық логарифмге айналдырсақ: 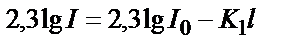 . Осы теңдеуді өзгерте отырып мынадай теңдік алуға болады:
. Осы теңдеуді өзгерте отырып мынадай теңдік алуға болады: 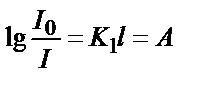 . Сонда
. Сонда 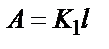 . Яғни,
. Яғни, 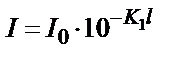 . Оптикалық тығыздық пен өткізгіштік арасындағы байланыс:
. Оптикалық тығыздық пен өткізгіштік арасындағы байланыс: 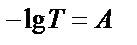 . Жарық жұтатын заттың концентрациясы (С) мен оптикалық тығыздықтың (А) арасындағы байланыс Бер заңымен анықталады. Бұл заң бойынша ерітіндінің қалыңдығы тұрақты болса оптикалық тығыздықтың мәні ерітіндінің концентрациясына тура пропорционалды:
. Жарық жұтатын заттың концентрациясы (С) мен оптикалық тығыздықтың (А) арасындағы байланыс Бер заңымен анықталады. Бұл заң бойынша ерітіндінің қалыңдығы тұрақты болса оптикалық тығыздықтың мәні ерітіндінің концентрациясына тура пропорционалды: 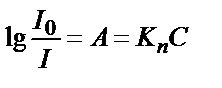 .
.
Бұндағы, Kn – пропорционалдық коэффициенті; С – анықталатын заттың концентрациясы.
Боялған ерітіндінің бойынан өткен монохроматты жарық шоғының интенсивтігі (I), түскен жарық шоғының интенсивтігі (I0), боялған қосылыстың концентрациясы (С) және ерітіндінің қалыңды (l) арасындағы байланысты жалпы Бугер-Ламберт-Бер заңымен өрнектейді:
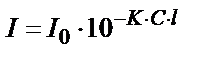 (14.2)
(14.2)
K – жарықжұту коэффициенті. Бұл мән 1) еріген заттың табиғатына; 2) температураға; 3) еріткішке және 4) жарық толқынының ұзындығына байланысты. Егер С=1 моль/л; l = 1см болса, онда (K) – молярлы жарық жұту коэффициенті деп аталады да, 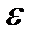 деп белгіленеді. Молярлы жарық жұту коэффициенті деп қалыңдығы 1см кюветадағы 1М ерітіндінің оптикалық тығыздығын айтады, оны
деп белгіленеді. Молярлы жарық жұту коэффициенті деп қалыңдығы 1см кюветадағы 1М ерітіндінің оптикалық тығыздығын айтады, оны 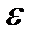 -деп белгілейді.
-деп белгілейді. 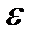 - ерітіндінің қалыңдығы мен концентпрациясына тәуелді емес, ол боялған қосылыстың табиғатын көрсетеді. Бұл кезде
- ерітіндінің қалыңдығы мен концентпрациясына тәуелді емес, ол боялған қосылыстың табиғатын көрсетеді. Бұл кезде  . Жарық жұтудың негізгі заңы толық сақталғанда ерітіндінің оптикалық тығыздығы (А) молярлы жарық жұту коэффициентіне, жарық жұтатын заттың концентрациясына және ерітіндінің калыңдығына тікелей тәуелді:
. Жарық жұтудың негізгі заңы толық сақталғанда ерітіндінің оптикалық тығыздығы (А) молярлы жарық жұту коэффициентіне, жарық жұтатын заттың концентрациясына және ерітіндінің калыңдығына тікелей тәуелді:
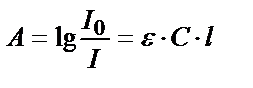 (14.3)
(14.3)
Молярлы жарық жұту коэффициентінің теориялық мәні 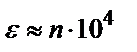 . Бугер-Ламберт-Бер заңын қолданып анықтайтын заттың анықталу шегін (Смин) табуға болады. (3) – теңдіктен
. Бугер-Ламберт-Бер заңын қолданып анықтайтын заттың анықталу шегін (Смин) табуға болады. (3) – теңдіктен 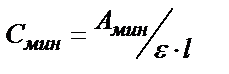 . Егер l = 1см болса және А=0,005 болса, онда
. Егер l = 1см болса және А=0,005 болса, онда 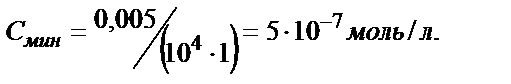 Егер заттың анықтау шегін одан әрі азайту қажет болса ерітіндінің қалыңдығын көбейту керек.
Егер заттың анықтау шегін одан әрі азайту қажет болса ерітіндінің қалыңдығын көбейту керек.
Бугер-Ламберт-Бер заңы белгілі жағдайда сұйытылған ерітінділер үшін әділетті. Бугер-Ламберт-Бер заңы мына жағдайларда ғана сақталады:
1) ерітіндідегі жарық жұтатын бөлшектердің құрамы тұрақты болуы және өзгермеуі керек. Ол үшін аналитикалық реакцияның химизміне байланысты жүргізу жолын мұқият қадағалау керек;
2) ерітіндіден өтетін жарық шоғының монохроматты және параллельді болуы керек;
3) температура тұрақты болуы керек.
Егер ерітінді Бугер-Ламберт-Бер заңына бағынбаса, онда заттың анықталуында тұрақты қате пайда болады. Бугер-Ламберт-Бер заңының сақталмауының біріншіде химиялық, екіншіден инструменталдық (құралдық) себептері болады. Анықтайтын затпен химиялық реакция жүргізгенде жарық жұтатын қосылыс түзу реакциясымен қатар (бөгде) реакциялар жүруі мүмкін. Соның нәтижесінде анықталатын зат жарық жұтатын бөлшекке толық айналмайды. Ескеретін бір нәрсе: Бугер-Ламберт-Бер заңы оптикалық тығыздықтың (А) тек жарық жұтатын бөлшектердің концентрациясына тәуелділігін көрсетеді, ал анықталатын ерітіндінің жалпы концентрациясына тәуелді емес. Анализдің дұрыс болуы үшін және қатені азайту мақсатында анықталатын затты түгел жарық жұтатын бояулы қосылысқа айналдыру керек. Бугер-Ламберт-Бер заңының сақталмауының инструментальды себебі: ол жарықтың монохроматты болмауы. Бұған дейін қорытылып шығарылған (14.1-14.3) теңдіктер тек монохроматты жарық үшін қолданылады.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1307; Нарушение авторских прав?; Мы поможем в написании вашей работы!