
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Самопроизвольные и несамопроизвольные процессы
|
|
|
|
Обратимые и необратимые процессы.
Обратимые процессы – это процессы, при протекании которых система возвращается в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
Самопроизвольные – процессы, происходящие сами собой не требующие затраты энергии извне и приближающие систему к равновесию.
Несамопроизвольные – процессы, требующие затраты энергии извне.
Отметим некоторые частные виды процессов:
а) изотермический (T = const);
б) изобарный (p = const);
в) изохорный (V = const);
г) адиабатический (нет обмена теплотой между системой и окружающей средой);
д) изобарно-изотермический (p = const, T = const);
е) изохорно-изотермический (V = const, T = const).
Мерой способности системы совершать работу является энергия. За энергию системы в термодинамике принимается ее внутренняя энергия (U) – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. При переходе системы из одного состояния в другое количественное изменение внутренней энергии равно:
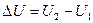 (1)
(1)
Работа ( W ) и теплота (Q) – две возможные формы передачи энергии от одой системы к другой.
В случае работы энергия передается путем согласованного, упорядоченного, движения частиц. Работа положительна (W > 0), если она совершается системой против внешних сил, и отрицательна (W < 0), если она выполняется над системой.
В случае теплоты – энергия передается путем хаотического движения частиц тела. Она положительна (Q > 0), если теплота поступает в систему (процесс называется эндотермическим), и отрицательна (Q < 0), если теплота отводится из системы (экзотермический процесс).
В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы. Передача теплоты или совершение работы осуществляются лишь в процессе взаимодействия системы с внешней средой или другой системой, поэтому Q и W являются функциями процесса.
|
|
|
Свойства системы, не зависящие от ее предыстории и полностью определяемые состоянием системы в данный момент (т.е. совокупностью ее параметров), называются функциями состояния. Функциями состояния являются, например, внутренняя энергия, энтальпия, энтропия, энергия Гиббса, энергия Гельмгольца. В отличие от функции процесса, изменение функции состояния не зависит от пути перехода между состояниями (1) и (2), а бесконечно малое изменение функции состояния обладает свойствами полного дифференциала.
Первый закон термодинамики представляет собой постулат. Истинность этого закона подтверждается тем, что ни одно из его следствий не находится в противоречии с опытом. Приведем некоторые формулировки первого закона термодинамики:
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!