
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 22 страница
|
|
|
|
Оксид углерода(П) очень ядовит и особенно опасен тем, что не имеет запаха; поэтому отравление им может произойти незаметно. Ядовитое действие оксида углерода, известное под названием угара, объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшееся соединение (карбоксигемоглобин) постепенно разрушается, и гемоглобин восстанавливает способность поглощать кислород.
157. Соединения углерода с серой и азотом. Из соединений углерода с серой и азотом большое практическое значение имеют сероуглерод CS2 и синильная кислота HCN.
Сероуглерод CS2 получается пропусканием паров серы сквозь слой раскаленного угля. Это бесцветная, сильно преломляющая свет летучая жидкость, кипящая при 46 °С. При долгом хранении сероуглерод желтеет и приобретает неприятный запах.
Сероуглерод ядовит и легко воспламеняется. В нем хорошо растворяются сера, фосфор, иод, различные жиры и смолистые вещества. Сероуглерод используется для борьбы с вредителями растений и для получения вискозы (стр. 480).
Синильная кислота HCN. При высокой температуре, например в электрической дуге, углерод может непосредственно соединяться с азотом, образуя бесцветный ядовитый газ дициан, молекулярная масса которого соответствует формуле C2N2. По своим химическим свойствам дициан имеет некоторое сходство с галогенами. Подобно им, ои образует соединение с водородом HCN, обладающее кислотными свойствами и получившее название циановодорода, или синильной кислоты.
Синильная кислота— бесцветная, очень летучая жидкость, кипящая при 26,7 °С и обладающая характерным запахом горького миндаля.
|
|
|
В водном растворе синильная кислота только в незначительной степени диссоциирует иа ионы (К= 8- Ю-10).
Синильная кислота-—сильный яд, действующий смертельно даже в ничтожных дозах (меньше 0,05 г).
Соли синильной кислоты называются цианидами. Из них наибольшее применение имеет цианид калия.
Цианид калия KCN — бесцветные кристаллы, хорошо растео< римые в воде. Цианид калия так же ядовит, как и синильная кие* лота. На воздухе под действием С02 он довольно быстро разлагается, выделяя синильную кислоту и превращаясь в карбонат:
2K.CN + Н20 + С02 = К2С03 + 2HCN
Как соль очень слабой кислоты, цианид калия в воде в сильной степени подвергается гидролизу:
CN" + Н20 HCN + ОН"
Поэтому раствор цианида калия имеет щелочную реакцию й сильно пахнет синильной кислотой. Аналогичными свойствами обладает и цианид натрия.
Цианиды калия и натрия способны растворять в присутствии кислорода воздуха золото и серебро. На этом основано их приме-: иение для извлечения этих металлов из руд (см. § 202). Кроме того, они используются в органическом синтезе, при гальваниче-* ском золочении и серебрении.
158. Топливо и его виды. Нефть, природный газ, каменный уголь, а также многие соединения углерода играют важнейшую роль в современной жизни как источники получения энергии. При сгорании угля и углеродсодержащих соединений выделяется теплота, которая используется для производственных процессов, отопления, приготовления пищи. Большая же часть получаемой теплоты превращается в другие виды энергии и затрачивается на совершение механической работы.
К основным видам топлива относятся ископаемый уголь, торф, дрова, нефть и природный газ.
Ископаемый уголь используется как непосредственно для сжигания, так и для переработки в более ценные виды топлива — кокс, жидкое горючее, газообразное топливо.
В царской России добыча угля не удовлетворяла потребностей даже слабо развитой промышленности, и каменный уголь дополнительно ввозился из-за границы. Единственным поставщиком угля для всей страны был тогда Донбасс.
|
|
|
После Октябрьской революции в угольной промышленности произошли огромные изменения. Освоены новые угольные бассейны: в Средней Азии, на Кавказе, в Восточной Сибири. Начата разработка каменного угля и в ряде других районов страны. В 1940 г. в Советском Союзе.было добыто угля 166 млн. т, в 1954 г.— 347 млн. т, а в 1985 — 726 млн. т. Однако доля угля в общем производстве топлива все время снижается за счет увеличения доли нефти и природного газа.
Ископаемый уголь представляет собой остатки древнего растительного мира. Чем старше уголь, тем богаче он углеродом.
Различают три главных вида ископаемых углей.
Антрацит — самый древний из ископаемых углей. Отличается большой плотностью и блеском. Содержит в среднем 95% углерода. В общих запасах углей СССР он составляет около 5,5%.
Каменный уголь содержит 75—90% углерода. Из всех ископаемых углей находит самое широкое применение.
Бурый уголь содержит 65—70% углерода. Имеет бурый цвет. Как самый молодой из ископаемых углей, часто сохраняет следы структуры дерева, из которого он образовался. Бурый уголь отличается большой гигроскопичностью и высокой зольностью (от 7 до 38%), поэтому используется только как местное топлизо и как сырье для химической переработки. В частности, путем его гидрогенизации получают ценные виды жидкого топлива — бензин и керосин.
Торф — продукт первой стадии образования ископаемых углей. Ои отлагается иа дне болот из отмирающих частей болотных Мхов. По разведанным запасам торфа СССР — самая богатая страна в мире. Содержание углерода в торфе составляет 55—60 %..Главный недостаток торфа для топлива — высокая зольность. Он используется как местное топливо,
При сухой перегонке торфа получают некоторые ценные химические продукты, а также торфяной кокс, содержащий очень мало серы, что позволяет применять его для выплавки высококачественного чугуна.
Дрова занимают второстепенное место в общем балансе топлива. В последние годы их применение в промышленности непрерывно уменьшается.
Нефть как топливо получила широкое применение с тех пор, как в конце XIX века был изобретен двигатель внутреннего сгорания, работающий на продуктах переработки нефти.
|
|
|
Однако нефть — не только удобное и высококалорийное топливо, но и важнейший вид сырья для производства самых разнообразных химических продуктов (синтетических спиртов, моющих средств, каучукоподобных материалов* растворителей и др.). Широко используют в качестве сырья для химической промышленности также попутные газы нефтедобычи и газы нефтепереработки. Добыча нефти в СССР возрастает из года в год:
Годи Млн. т Годы Млн, т
1913 10,3 1954 59,3
1940 31,1 1985 595 (включая газовый конденсат)
Природный газ, состоящий из метана и других предельных углеводородов, — весьма дешевое и удобное топливо. Значение природного газа видно хотя бы из того, что за 25 лет (1937—■ 1962 гг.) его добыча в капиталистических странах увеличилась почти в 6 раз.
В нашей стране использование природного газа началось практически только в послевоенные годы. Мощные месторождения природного газа были открыты в Украинской ССР, Краснодарском крае, Средней Азии и в ряде районов Сибири. В настоящее время построено много магистральных газопроводов большой протяженности. Они связывают источники добычи природного газа с районами его промышленного и бытового потребления.
Газовая промышленность относится к числу наиболее быстро развивающихся отраслей нашей тяжелой индустрии. Темпы ее роста характеризуются размерами добычи природного газа и получения газа путем переработки угля и сланцев. Общее количество полученного в нашей стране газа составило:
Годы
1913 1940
Млрд. м3
0,02 3,2
Годы
1955 1985
Млрд. м3
10,4 643
Будучи прекрасным топливом, природный газ является в то же время иключительно ценным и экономически выгодным сырьем для промышленности органического синтеза. На базе природного газа в нашей стране построен ряд новых химических заводов;
осуществляется также перевод на этот вид сырья действующих химических предприятий.
Одинаковые количества топлива дают при сжигании различные количества теплоты. Поэтому для оценки качества топлива определяют его теплотворную способность, т.е. количество теплоты, выделяющейся при полном сгорании 1 кг топлива.
|
|
|
Приведем примерные значения теплотворной способности (в кДж/кг) различных видов топлива:
Дерево сухое 19 000 Антрацит 34 000
Торф сухой 23 000 Древесный уголь 34 000
Бурый уголь 28 000 Нефть 44 000
Каменный уголь 35 000 Природный газ 50 000
159. Газообразное топливо. По величине теплотворной способности все виды твердого топлива и нефть уступают природному газу. Высокая калорийность газообразного топлива обусловлена тем, что при его сгорании не затрачивается энергия на разрыв связей между атомами углерода, как в твердом топливе или в больших молекулах углеводородов нефти. Кроме того, газообразное топливо полностью смешивается с воздухом, так что при его сжигании требуется лишь очень небольшой избыток кислорода по сравнению с теоретической величиной. Это снижает потери теплоты на нагрев избытка кислорода (воздуха). Газ можно предварительно нагревать, благодаря чему повышается температура пламени. Его удобно транспортировать на большие расстояния, пользуясь газопроводами.
К важнейшим видам газообразного топлива относятся: природный газ (см. § 158), генераторные газы, коксовый газ.
Генераторные газы получают из твердого топлива путем частичного окисления содержащегося в нем углерода при высокой температуре. Этот процесс называется газификацией твердого топлива. Он осуществляется в специальных устройствах — газогенераторах, представляющих собой вертикальную шахту, в которую сверху загружают топливо, а снизу вдувают воздух, кислород, водяной пар или смеси этих веществ. В зависимости от состава вдуваемых газов различают воздушный, водяной, паровоздушный (смешанный) и другие генераторные газы.
Воздушный газ получают при вдувании воздуха. В нижней части генератора протекает реакция:
С + 02 = С02 + 393,5 кДж
Вследствие большого количества выделяющейся теплоты, температура достигает 1400—1600 °С, вышележащие слои угля раскаляются и уголь взаимодействует с С02:
С + С02 = 2GO — 172 кДж
Получающийся газ в основном состоит из оксида углерода (II) и азота,
160. Общая характеристика органических соединений
Паровоздушный (смешанный) газ получают при вдувании смеси воздуха с водяным паром. В этом случае одновременно с вышеприведенными реакциями происходит взаимодействие углерода с водяным паром:
с + н2о = со + н2
Таким образом, в состав смешанного газа, кроме оксида углерода (II) и азота, входит водород, что повышает его теплотворную способность. Смешанный газ применяется в промышленности в качестве топлива. Он самый распространенный и дешевый из всех искусственных горючих газов.
Водяной газ получают при подаче на раскаленный уголь водяного пара. Газ содержит до 86% СО и Н2 и используется не в качестве горючего, а для синтеза химических продуктов.
Коксовым газом называется газ, получаемый нагреванием каменного угля до 900—1100 °С без доступа воздуха. Этот газ в чистом виде или в смеси с природным газом используется в качестве, топлива для нагревания мартеновских печей, печей стекольной и керамической промышленности, а также в коммунальном хозяйстве. Кроме того, коксовый газ служит сырьем при синтезе химических продуктов.
Коксовый газ представляет собой смесь различных горючих газов. Состав его зависит от исходного материала, но в среднем выражается следующими числами [в % (об.)]:
Водород 59 Оксид углерода(II) 6
Метан 25 Бесполезные примеси 7
Другие углеводороды 3 (С02, N2, 02)
Подземная газификация угля. Превращение угля в газообразное топливо может быть осуществлено путем газификации угля непосредственно в местах залегания (под землей). Впервые мысль о возможности такого процесса была высказана Менделеевым в 1888 г.
В настоящее время в СССР и в ряде зарубежных стран проводятся работы по подземной газификации каменных углей и горючих сланцев.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
160. Общая характеристика органических соединений. Соединения углерода (за исключением некоторых наиболее простых) издавна получили название органических соединений, так как в природе они встречаются почти исключительно в организмах животных и растений, принимают участие в жизненных процессах или же являются продуктами жизнедеятельности или распада организмов. В отличие от органических соединений, такие вещества, как песок, глина, различные минералы, вода, оксиды углерода, угольная кислота, ее соли и другие, встречающиеся в
«неживой природе», получили название неорганических или минеральных веществ.
Деление веществ на органические и неорганические возникло вследствие своеобразия органических соединений, обладающих специфическими свойствами. Долгое время считалось, что углерод-содержащие вещества, образующиеся в организмах, в принципе, невозможно получать путем синтеза из неорганических соединений.
Образование органических веществ приписывалось влиянию особой, недоступной познанию «жизненной силы», действующей только в живых организмах и обусловливающей специфику органических веществ. Это учение, явившееся разновидностью идеалистических представлений о природе, получило название витализма (от латинского vis vitalis — жизненная сила). Виталисты пытались в явлениях живой природы найти доказательство существования в мире каких-то таинственных сил, не поддающихся изучению и не подчиняющихся общим физико-химическим законам. Концепция виталистов была наиболее полно сформулирована одним из самых авторитетных химиков первой половины XIX века — шведским ученым И. Я. Берцелиусом. Виталистические воззрения мешали прогрессу в изучении природы органических веществ и были опровергнуты в ходе развития науки.
В 1824 г. немецкий химик Ф. Велер, ученик Берцелиуса, впервые получил из неорганического вещества дициана NC—CN при нагревании его с водой щавелевую кислоту НООС—СООН — органическое соединение, которое до тех пор добывалось только из растений. В 1828 г. Велер осуществил первый синтез вещества животного происхождения: нагреванием неорганического соединения цианата аммония NH4CNO получил мочевину (карбамид)' (МН2)гСО; это вещество до тех пор выделяли лишь из мочи.
Вскоре были осуществлены в лабораторных условиях синтезы и других органических веществ: в 1845 г. в Германии Г. Кольбе синтезировал уксусную кислоту, в 1854 г. во Франции М. Бертло синтетическим путем получил жир, в 1861 г. в России А. М. Бутлеров осуществил синтез сахаристого вещества и т. д.
| * Гормоны — вещества, выделяемые железами внутренней секреции—> регуляторы важнейших функций организма животных и человека (так, инсулин— гормои поджелудочной железы, — регулятор сахарного обмена), Фер«. менты —см. стр. 172, |
В настоящее время путем синтеза получают множество органических соединений. Более того, оказалось, что многие органические вещества гораздо проще и дешевле получать синтетически, чем выделять из природных продуктов. Наибольшим успехом химии 50—60-х годов XX века явился первый синтез простых белков—■ гормона инсулина и фермента * рибонуклеазы. Таким образом доказана возможность синтетического получения даже белков — наиболее сложных органических веществ, являющихся непременными участниками жизненных процессов; по определению Ф. Энгельса: «Жизнь есть способ существования белковых тел».
С развитием синтеза органических соединений была уничтожена грань, отделяющая эти соединения от неорганических, однако название «органические соединения» сохранилось. Большинство известных в настоящее время соединений углерода в организмах даже не встречаются, а получены искусственным путем.
161. Отличительные особенности органических соединений. Как уже указывалось, число изученных в настоящее время соединений углерода чрезвычайно велико. Но при всем многообразии природных органических веществ, они обычно состоят из небольшого числа элементов; в их состав, кроме углерода, почти всегда входит водород, часто кислород и азот, иногда сера и фосфор. Эти элементы были названы органогенами (т. е. элементами, порождающими органические молекулы) *.
Среди органических соединений особенно распространено я в -ление изомерии (см. § 162). Имеется множество соединений углерода, обладающих одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими, а зачастую и химическими свойствами. Например, состав С2Н60 и, соответственно, молекулярную массу 46,07 имеют два различных изомерных органических вещества: этиловый спирт—жидкость, кипящая при 78,4 °С, смешивающаяся с водой в любых соотношениях, и диметиловый эфир — газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химическим свойствам.
Явление изомерии, в частности, обусловливает огромное многообразие органических веществ.
| * С развитием химии путем синтеза получены органические вещества, содержащие и многие другие элементы. Соединения, в которых в непосредственной связи с углеродом имеются металлы (Li, Na, К, Mg, Zn, Hg, Al, Sn, Pb и др.) и некоторые неметаллы (например, Si, As), были названы элемент» органическими соединениями. ** Лишь синтетически получены цепные органические вещества, отличающиеся исключительной устойчивостью к действию окислителей и высоких температур. Таковы, например, перфторуглероды (перфторпарафины или перфтор-. алкапы), фторопласт и др. |
В отличие от минеральных органические вещества своеобразно ведут себя при нагревании. Их температуры плавления не превышают 350—400°С, в большинстве же они плавятся ниже 200— 100 °С. При нагревании без доступа воздуха органические вещества могут подвергаться глубоким изменениям, в результате которых образуются новые вещества, обладающие совершенно иными свойствами, или же (при температурах порядка 400—600 °С)—полному разложению и обугливанию. Если же вести нагревание в присутствии кислорода воздуха или других окислителей, то органические вещества обычно полностью сгорают**; при этом входящие в их состав углерод и водород целиком превращаются в диоксид углерода и воду, а азот обычно выделяется в свободном состоянии *.
Одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах. В подавляющем большинстве эти связи имеют ярко выраженный ковалент-ный характер. Поэтому органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом. Время, необходимое для завершения реакций между органическими веществами, обычно измеряется часами, а иногда и днями. Вот почему в органической химии применение различных катализаторов имеет особенно большое значение.
Наконец, следует еще раз подчеркнуть исключительную биологическую роль органических соединений. Многие из них являются непосредственными носителями, участниками или продуктами процессов, протекающих в живых организмах, или же — такие, как ферменты, гормоны, витамины и др. — биологическими катализаторами, инициаторами и регуляторами этих процессов.
162. Теория химического строения органических соединений. Химическая природа органических соединений, свойства, отличающие их от соединений неорганических, а также их многообразие нашли объяснение в с4>ормулированной Бутлеровым в 1861 г. теории химического строения (см. § 38).
Согласно этой теории, свойства соединений определяются их качественным и количественным составом, химическим строением, т. е. последовательным порядком соединения между собой образующих молекулу атомов, и их взаимным влиянием. Теория строения органических соединений, развитая и дополненная новейшими воззрениями в области химии и физики атомов и молекул, особенно представлениями о пространственной структуре молекул, о природе химических связей и о характере взаимного влияния атомов, составляет теоретическую основу органической химии **.
| * На этом основан количественный анализ органических веществ: содержание углерода и водорода в сгоревшем веществе определяют по количеству образовавшихся С02 и Н20, выделившийся N2 измеряют непосредственно по объему, а содержание кислорода устанавливают по разности между массой сгоревшего вещества и массой содержавшихся в нем других элементов. ** Учение Бутлерова о взаимном влиянии атомов подробнее разрабатывалось его учеником профессором Московского университета В. В. Марковнико-вым (1838—1904), а также многими другими его учениками и последователями как в нашей стране, так и эа рубежом. Изучение взаимного влияния атомов — одна из наиболее важных проблем современной химии органических соединений. |
В современной теории строения органических соединений основными являются следующие положения.
162. Теория химического строения органических соединений
1. Все особенности органических соединений определяются, прежде всего, свойствами элемента углерода.
| t t |
В соответствии с местом, которое углерод занимает в периодической системе, во внешнем электронном слое его атома (/.-оболочка) имеются четыре электрона. Он не проявляет выраженной склонности отдавать или присоединять электроны, занимает в этом отношении промежуточное положение между металлами и неметаллами и характеризуется резко выраженной способностью образовывать ковалентные связи. Структура внешнего электронного слоя атома углерода может быть представлена следующими схемами;
2s
С Г7Т
t t t
нормальное состояние возбужденное состояние
Возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет ковалентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав СН4. Строение его можно изобразить структурой (а) или электронно-структурной (или электронной) (б) формулами:
? н
Н—С—Н Н: С: II
а б
Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку (электронный октет), а атомы водорода — устойчивую двух-электронную оболочку (электронный дублет).
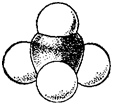
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве. Атом углерода находится как бы в центре тетраэдра (правильной четырехгранной пирамиды), а четыре соединенных с ним атома (в случае метана — четыре атома водорода)—в вершинах тетраэдра (рис. 120). Углы между направлениями любой пары связей (валентные углы углерода) одинаковы и составляют 109° 28'.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s- и трех р-орбиталей в результате 5р3-гибридизации образуются четыре симметрично расположенные в пространстве гибридные sp3-орбитали, вытянутые в направлении к вершинам тетраэдра.

В результате перекрывания я^-гибридных электронных облаков углерода с электронными облаками других атомов (в метане —■ с шаровыми облаками ls-электронов атомов водорода) образуются четыре тетраэдрически направленные ковалентные о-связи (рис. 121; см. также стр. 131).
Тетраэдрическое строение молекулы метана наглядно выражается ее пространственными моделями — шариковой (рис. 122) или сегментовой (рис. 123). Белые шарики (сегменты) изображают атомы водорода, черные — углерода. Шариковая модель характеризует лишь взаимное пространственное расположение атомов, сегментовая — дает, кроме того, представление об относительных межатомных расстояниях (расстояниях между ядрами атомов)1. Как показано на рис. 122, структурная формула метана может рассматриваться как проекция его пространственной модели на плоскость чертежа.
2. Исключительным свойством углерода, обусловливающим многообразие органических соединений, является способность его атомов соединяться прочными ковалентными связями друг с другом, образуя углеродные цепи практически неограниченной длины*
I I I I I
С—С—С—С—С
I I 1 I 1
Валентности атомов углерода, не пошедшие на взаимное соединение, используются для присоединения других атомов или групп (в углеводородах — для присоединения водорода).
| * Кроме углерода цепи из одинаковых атомов образует его аналог из {V группы — кремний; однако такие цепи содержат не более шести атомов Si, 1звестны длинные цепи из атомов серы, по содержащие их соединения непрочны. |
Так, углеводороды этан (СгН6) и пропан (С3Н8) содержат цепи соответственно из двух и трех атомов углерода. Строение их выра-
 | |||
 | |||
9Н
жают следующие структурные и электронные формулы;
н н н н н
II III
н—с—с—н н—с—с—с—н
II III
н н н н н
н н н н н
Н: С: С: Н Н: С: С: С: Н
н н НИН
этан пропан
Известны соединения, содержащие в цепях сотни и более атомов углерода.
Наращивание углеродной цепи на один атом углерода ведет к увеличению состава на группу СН2. Такое количественное изменение состава приводит к новому соединению, обладающему несколько иными свойствами, т. е уже качественно отличающемуся от исходного соединения; однако общий характер соединений сохраняется. Так, кроме углеводородов метана (СН4), этана (С2Н6), пропана (C3Hs) существуют бутан (С4Н"ю), пентан (С5Н12) и т. д. Таким образом, в огромном многообразии органических веществ могут быть выделены ряды однотипных соединений, в которых каждый последующий член отличается от предыдущего на группу СНг. Такие ряды называют гомологическими рядами, их члены по отношению друг к другу являются гомологами, а существование таких рядов называется явлением гомологии.
Следовательно, углеводороды метан, этан, пропан, бутан и т. д. — гомологи одного и того же ряда, который называют р я -дом предельных, или насыщенных, углеводородов (алканов) или, по первому представителю,— рядом метана.
Вследствие тетраэдрической направленности связей углерода, его атомы, входящие в цепь, располагаются не на прямой, а зигзагообразно, причем, благодаря возможности вращения атомов

Такая структура цепей дает возможность сближаться концевым (б) или другим не смежным атомам углерода (в); в результате возникновения связи между этими атомами углеродные цепи могут замыкаться в кольца (циклы), например:
\/ \/ III
с—с —с—с—с—
\/ 1 1 I
х г> с — О С
\ /I I
с
/\
a- s
Таким образом, многообразие органических соединений определяется и тем, что при одинаковом числе атомов углерода в молекуле возможны соединения с открытой, незамкнутой цепью углеродных атомов, а также вещества, молекулы которых содержат циклы (циклические соединения).
3. Ковалентные связи между атомами углерода, образованные одной парой обобщенных электронов, называют простыми (или ординарными) связями.
Связь между атомами углерода может осуществляться не одной, а двумя или тремя общими парами электронов. Тогда получаются цепи с кратными — двойными или тройными связями; эти связи можно изобразить следующим образом:
—с=с—

| н |
| / |
| \ |
Простейшие соединения, содержат дороды этилен (с двойной связью) связью):
| н/ |
Н.
с=с,
| н н 'с::с-н" 'н |
н—с=с—н
Hi С::С:Н
ацетилен
- углево-тройной
Углеводороды с кратными связями называются непредельными или ненасыщенными. Этилен и ацетилен — первые 
представители двух гомологических рядов — этиленовых и ацетиленовых углеводородов.
Простая ковалентная связь С—С (или С: С), образованная перекрыванием двух 5р3-гибридных электронных облаков по линии, соединяющей центры атомов (по оси связи), как, например, в этане (рис. 124), представляет собой а-связь (см. § 42). Связи С—Н также являются о-связями — они образуются перекрыванием по оси связи 5р3-гибридного облака атома С и шарового облака ls-электрона атома Н.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 390; Нарушение авторских прав?; Мы поможем в написании вашей работы!