
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 26 страница
|
|
|
|
Амины жирного ряда, содержащие простые углеводородные радикалы, встречаются в продуктах распада белков.
| -NH2 + 2Н20 |
Большое промышленное значение имеют ароматические амины, содержащие радикалы ароматических углеводородов. Важнейшим из них является анилин CeH5—NH2. Его получают восстановлением нитробензола в присутствии катализатора:
Л \ катализатор /, ^
// \>—N02 + 3H2 ------------------- у- (' ^
нитробензол анилин
 Эта реакция была открыта в 1842' г. Н. Н. Зининым и называется реакцией Зинина. Значение этого открытия трудно переоценить. Анилин и другие ароматические амины, которые подобным образом получаются из различных нитросоединений, используются для производства многочисленных синтетических красителей, лекарственных веществ, фотореактивов, пластмасс, взрывчатых веществ и других ценных материалов.
Эта реакция была открыта в 1842' г. Н. Н. Зининым и называется реакцией Зинина. Значение этого открытия трудно переоценить. Анилин и другие ароматические амины, которые подобным образом получаются из различных нитросоединений, используются для производства многочисленных синтетических красителей, лекарственных веществ, фотореактивов, пластмасс, взрывчатых веществ и других ценных материалов.
Николай Николаевич 3 и н и н выдающийся русский химик, основатель знаменитой Казанской школы химиков-органиков, родился в 1812 г. Научная и педагогическая деятельность Зинина протекала вначале в Казанском университете, где им была в 1842 г. открыта реакция получения анилина. В химической лаборатории университета до сих пор бережно хранится небольшое количество анилина, полученного лично Зинииьгм. В 1847 г. Зииин переехал в Петербург и занял кафедру в Медико-хирургической академии, а в 1865 г. он был избран академиком.
Кроме синтеза анилина, Зинин осуществил также ряд других органических синтезов, имевших большое практическое значение.
Зниин был первым президентом основанного в 1868 г. Русского химического общества (ныне Всесоюзное химическое общество имени Д. И. Менделеева).
176. Аминокислоты и белки. Большое биологическое значение имеют аминокислоты — соединения со смешанными функциями, в которых, как в аминах, содержатся аминогруппы —NH2 и одновременно, как в кислотах, — карбоксильные группы — СООН, В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту, или аланин. Строение других природных аминокислот этого типа можно выразить приведенной ниже общей формулой (где R — углеводородный радикал, который может содержать и различные функциональные группы)5
|
|
|
' s Т'/> '? />
H2N—СН2—С^ H2N~CH—H2N—СН— СУ
Х)Н \эн чон
глицин аланин общая формула
природных аминокислот
Аминокислоты — амфотерные соединения: они образуют соли с основаниями (за счет карбоксильной группы) и с кислотами (за счет аминогруппы).
Ион водорода, отщепляющийся при диссоциации от карбоксила аминокислоты, может переходить к ее аминогруппе с образованием аммониевой группировки. Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей):
R R
I * I
H2N—СН—СООН =f=±: H3N—СН—COO"
аминокислота биполярный ион(внутренняя соль)
Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную ре-, акцию.
Из молекул аминокислот строятся молекулы белковых веществ, или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот.
Белки — природные высокомолекулярные азотсодержащие органические соединения. Они играют первостепенную роль во всех жизненных процессах, являются носителями жизни. Белки содержатся во всех тканях организмов, в крови, в костях. Ферменты (энзимы), многие гормоны представляют собой сложные белки. Кожа, волосы, шерсть, перья, рога, копыта, кости, нити йатураль-. ного шелка образованы белками. Белок, так же как углеводы и жиры, — важнейшая необходимая составная часть пищи.
|
|
|
В состав белков входят углерод, водород, кйслОрбД, азот и часто сера, фосфор, железо. Молекулярное массы белков очень' велики —от 1500 до нескольких миллионов,
Проблема строения и синтеза белков — одна из важнейших в Современной науке. В этой области в последние десятилетия достигнуты большие успехи. Установлено, что десятки, сотни и тысячи молекул аминокислот, образующих гигантские молекулы белков, соединяются друг с другом, выделяя воду за счет карбоксильных и аминогрупп; структуру цепи такой молекулы можно представить тэке
R R' R R" R'"
H2N—СН—С-------- NH—СН—С—NH—СН—С—NH—СН-С---------- NH-CH-C*^
о ооо 40,1
В молекулах белков многократно повторяются группы атомов >—СО—NH—; их называют а м и д н ы м и, или в химии белков — пептидными группами. Соответственно белки относят к природным высокомолекулярным полиамидам или полипептидам.
Все многообразие белков образовано 20 различными аминокислотами; при этом для каждого белка строго специфичной является последовательность, в которой остатки входящих в его состав аминокислот соединяются друг с другом. Найдены методы выяснения этой последовательности; в результате уже точно установлено строение некоторых белков. И самым замечательным достижением в этой области явилось осуществление синтеза из аминокислот простейших белков: как уже указывалось, в 50—60-х годах XX века синтетически получены гормон инсулин и фермент рибонуклеаза. Таким образом, доказана принципиальная возможность синтеза еще более сложных белков.
177. Природные и синтетические высокомолекулярные соединения (полимеры). Высокомолекулярными соединения-м и, или полимерами, называют сложные вещества с большими молекулярными массами (порядка сотен, тысяч и миллионов)', молекулы которых построены из множества повторяющихся элементарных звеньев, образующихся в результате взаимодействия и соединения друг с другом одинаковых или разных простых молекул — мономеров.
Следующие два процесса приводят к образованию высокомолекулярных соединений: а) реакция полимеризации — про* цесс, в результате которого молекулы низкомолекулярного соединения (мономера) соединяются друг с другом при помощи ковалентных связей,образуя новое вещество (полимер),молекулярная, масса которого в целое число раз больше, чем у мономера; полимеризация характерна, главным образом, для соединений с кратными (двойными или тройными) связями; б) реакции п о л и к о н д е н с а Ци й — процесс образования полимера из низкомолекулярных соединений, содержащих две или несколько функциональных групп, сопровождающийся выдедением за счет этих групп таких веществ, как вода, аммиак, галогеноводород и т. п.; состав элементарного звена полимера в этом случае отличается от состава исходного мономера.
|
|
|
Примерами природных высокомолекулярных соединений могут служить крахмал и целлюлоза, построенные из элементарных звеньев, являющихся остатками моносахарида (глюкозы), а также белки, элементарные звенья которых представляют собой остатки аминокислот; сюда же относятся природные каучуки (см. ниже).
Все большее значение приобретают синтетические высокомолекулярные соединения или, как их иначе называют, синтетические в ы с о к о п о л и"м е р ы. Это разнообразные материалы, обычно получаемые из доступного и дешевого сырья; на их основе получают пластические массы (пластмассы)—сложные композиции, в которые вводят различные наполнители и добавки, придающие полимерам необходимый комплекс технических свойств, — а также синтетические волокна (см. § 177).
Полимеры и пластмассы на их основе являются ценными заменителями многих природных материалов (металлов, дерева, кожи, клеев и т. п.). Синтетические волокна успешно заменяют натуральные— шелковые, шерстяные, хлопчатобумажные. При этом важно подчеркнуть, что по ряду свойств материалы на основе синтетических полимеров часто превосходят природные. Можно получать пластические массы, волокна и другие соединения с комплексом заданных технических свойств. Это позволяет решать многие задачи современной техники, которые не могли быть решены при использовании только природных материалов. Народнохозяйственные планы нашей страны предусматривают широкое и все увеличивающееся развитие производства синтетических полимеров и разнообразных материалов на их основе *.
|
|
|
Полимеризац ионные смолы. К полимеризационным смолам относятся полимеры, получаемые реакцией полимеризации преимущественно этиленовых углеводородов или их производных.
Полиэтилен—представляет собой полимер, образующийся при
полимеризации этилена, например, при сжатии его до 150—
250 МПа при 150—250 °С (полиэтилен высокого давления)
• •■ + СН2=СН2 + CHi=CH2 + СН2=СН2 +... ■—>
■—>----------------------------- CHj—сн2—сн2—сн2-сн2—сн2---------------
полиэтилен
или сокращенно:
иСН2=СН2 —► (—сн2-сн2-)„
| * В 1985 г. в СССР произведено 5,0 млн. т пластических масс н смол. К 1990 г. их производство должно возрасти до 6,8—7,1 млн. т. |
этилен полиэтилен
Реакцию полимеризации можно представить как результат раскрытия двойных связей в множестве молекул непредельного соединения (в данном случае этилена) и последующего соединения этих молекул друг с другом в одну гигантскую макромолекулу. Величина п выражает степень полимеризации — указывает число мономерных звеньев, образующих макромолекулу. Начало полимеризации этилена вызывается введением небольшого количества (0,05—0,1 %) кислорода.
Найдены катализаторы, благодаря которым этилен полимери-зуется при низких давлениях. Например, в присутствии триэтил-алюминия (С2Н5)3А1 с добавкой хлорида титана (IV) ТЮЦ (катализатор Циглера) полимеризация протекает при атмосферном давлении (получается полиэтилен низкого давления); на оксидах хрома (катализатор Филипса) полимер образуется при давлении до 10 МПа (полиэтилен среднего давления).
Полиэтилен — предельный углеводород с молекулярной массой от 10 000 до 400 000. Он представляет собой бесцветный полупрозрачный в тонких и белый в толстых слоях, воскообразный, но твердый материал с температурой плавления ПО—125°С. Обладает высокой химической стойкостью и водонепроницаемостью, малой газопроницаемостью. Его применяют в качестве электроизоляционного материала, а также для изготовления пленок, используемых в качестве упаковочного материала, для изготовления легкой небьющейся посуды, шлангов и трубопроводов для химической промышленности. Свойства полиэтилена зависят от способа его получения; например, полиэтилен высокого давления обладает меньшей плотностью и меньшей молекулярной массой (10 000—-45 000), чем полиэтилен низкого давления (молекулярная масса 70 000—400 000), что сказывается на технических свойствах. Для контакта с пищевыми продуктами допускается только полиэтилен высокого давления, так как полиэтилен низкого давления может содержать остатки катализаторов — вредные для здоровья человека соединения тяжелых металлов.
Полипропилен — полимер пропилена, следующего за этиленом гомолога непредельных этиленовых углеводородов:
«сн2=сн —* сн,—дн-сн2—сн—
I 1 1
СНз СН, СН,
пропилен полипропилен
Полимеризация протекает в присутствии катализаторов. В зависимости от условий полимеризации получают полипропилен, различающийся по структуре макромолекул, а следовательно, и по свойствам. По внешнему виду это каучукоподобная масса, более или менее твердая и упругая. Отличается от полиэтилена боле$ высокой температурой плавления. Например, полипропилен с молекулярной массой выше 80 000 плавится при 174—175 °С.
Используют полипропилен для электроизоляции, для изготовления защитных пленок, труб, шлангов, шестерен, деталей приборов, а также высокопрочного и химически стойкого волокна. Последнее применяют в производстве канатов, рыболовных сетей и др. Пленки из полипропилена значительно прозрачнее и прочнее полиэтиленовых, пищевые продукты в упаковке из полипропилена можно подвергать стерилизации, варке и разогреванию.
Полистирол — образуется при полимеризации стирола:
лСН2=СН —>----------- СН2— СН— СН2—СН— сн2—сн
I I I I
С0Н5 CgHs СдН5 С5Н5
стирол полистирол
Он может быть получен в виде прозрачной стеклообразной массы. Применяется как органическое стекло, для изготовления промышленных товаров (пуговиц, гребней и т. п.), в качестве электроизолятора.
Поливинилхлорид (полихлорвинил) — получается полимеризацией винилхлорида:
fiCH2=CH —>------------ СН2—СН—СН2—СН—СН2—СН
I III
С1 С1 С1 С1
Ешшлхлорид поливинилхлорид
(хлористый винил)
Это — эластичная масса, очень стойкая к действию кислот и щелочей. Широко используется для футеровки труб и сосудов в химической промышленности. Применяется для изоляции электрических проводов, изготовления искусственной кожи, линолеума, непромокаемых плащей. Хлорированием поливинилхлорида получают перхлорвиниловую смолу, из которой готовят химически стойкое синтетическое волокно хлорин.
Политетрафторэтилен — полимер тетрафторэтилена:
«CF2=CF2 —> (—CF2— CF2—)„ тетрафторэтилен политетрафторэтилен
Политетрафторэтилен выпускается в виде пластмассы, называемой тефлоном или фторопластом. Весьма стоек по отношению к щелочам, концентрированным кислотам и другим реагентам. По химической стойкости превосходит золото и платину. Негорюч, обладает высокими диэлектрическими свойствами. Применяется В химическом машиностроении, электротехнике.
Полиакрилаты и полиакрилонитрил. Важное значение имеют полимеры непредельных акриловой СН2=СН—СООН и метакри-ловой СН2=С(СНз1—СООН кислот, особенно их метиловых эфи
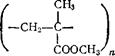
|
| /—СН2—СН—\ ч с^мЛ |
ров — метилакрилата и метилметакрилата, а также нитрила акриловой кислоты (или акрилонитрила) СНг = СН—C=N — производного этой кислоты, в котором карбоксильная группа —СООН заменена группой —CsN, Строение важнейших из этих полимеров выражается формулами:
/—СН2—СН— \
V. СООСНзЛ
полпметнлакрнлаг полиметилметакрилат полнакрнлоиитрил
Полиметилакрилат и полиметилметакрилат — твердые, бесцветные, прозрачные, стойкие к нагреванию и действию света, пропускающие ультрафиолетовые лучи полимеры. Из них изготовляют листы прочного и легкого органического стекла, широко применяемого для различных изделий. Из полиакрилонитрила получают нитрон (или орлон)—синтетическое волокно, идущее на производство трикотажа, тканей (костюмных и технических).
Каучук и — эластичные материалы, из которых путем специальной обработки получают резину. В технике из каучуков изготовляют шины для автотранспорта, самолетов, велосипедов; каучуки применяют для электроизоляции, а также производства промышленных товаров и медицинских приборов.
Натуральный (природный) каучук (НК) представляет собой высокомолекулярный непредельный углеводород, молекулы которого содержат большое число двойных связей; состав его может быть выражен формулой (CsHg)^ (где значение п составляет от.1000 до 3000); он является полимером изопрена:
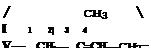 СНз / СН
СНз / СН
1 2| 3 4
лСН2=С—СН=СН2 -
изопрен натуральный каучук
(полиизопреи)
Как видно из этой схемы, при полимеризации изопрена раскры* ваются обе его двойные связи, а в элементарном звене полимера двойная связь возникает на новом месте — между атомами углерода 2 и 3.
Природный каучук содержится в млечном соке каучуконосных
растений, главным образом, тропических (например, бразильского
дерева гевея). ;
Другой природный продукт — гуттаперча — также является по«
лимером изопрена, но с иной конфигурацией молекул, '
Сырой каучук липок, непрочен, а при небольшом, понижении /температуры становится хрупким, Нтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, каучук подвергают вулканизации — вводят в него серу и затем нагревают. Вулканизованный каучук называется резиной.
При вулканизации сера присоединяется к двойным связям макромолекул каучука и «сшивает» их, образуя дисульфидные «мостики»,
S S
s s
1 [2 3 4 1 |г 3 4
-сн2—С—сн—сн2 - сн2—С—сн—сн2
| СНз S СНз S 1 12 |з 4 1 |г |з 4 - с- — — - - — -- |
СНз ^ СНз S
-сн2—с—сн—сн2—сн2—с—сн—сн2
I i
А_...
В результате вулканизации каучук теряет пластичность, становится упругим.
Отсутствие в нашей стране природного каучука вызвало необходимость в разработке метода искусственного получения этого важнейшего для народного хозяйства материала. Советскими химиками был найден и впервые в мире осуществлен (1928—1930)] р промышленном масштабе способ получения синтетического каучука.
По способу, предложенному С. В. Лебедевым (1874—1934), исходным материалом для производства синтетического каучука (СК) служит непредельный углеводород бутадиен, или дивинил, который полимеризуется подобно изопрену;
1 2 3 4 1 2 3 4
иСН2=СН—СН=СН2 —> (—СН2—СН=СН— СН2—)„
бутадиен синтетический каучук
(дивинил) (полибутадиен)
По Лебедеву, исходный бутадиен получают из этилового спирта. Теперь разработано получение его из бутана попутного нефтяного газа.
В настоящее время химическая промышленность производит много различных видов синтетических каучуков, превосходящих по некоторым свойствам натуральный каучук. Кроме полибута-диенового каучука (СКВ), широко применяются сополимер-ные к а учу к и — продукты совместной полимеризации (со по-лимеризации) бутадиена с другими непредельными соедине-;
ниями, например со стиролом (СКС)' или с акрилонитрилом (СКН);
12 3 4
/—СН2—СН=СН—СН2—СН2—СН—
V с6н5
бутадиен-стирольныя каучук
/—СН2—СН==СН—СН2—СН2—СН—
I I
V C==N
бутадизн-нитрильный каучук
В молекулах этих каучуков звенья бутадиена чередуются со звеньями соответственно стирола и акрилонитрила.
В СССР разработано и внедрено в производство получение синтетического полиизопренового каучука (СКИ), близкого по свойствам к натуральному каучуку.
Конденсационные смолы — к ним относят полимеры, получаемые реакцией поликонденсации.
Фенолоформальдегидные смолы. Эти высокомолекулярные соединения образуются в результате взаимодействия фенола (C6H5OHJ с формальдегидом (СН2=0) в присутствии кислот (НС1 и др.) или щелочей (NaOH, NH4OH) в качестве катализаторов. Образование фенолоформальдегидных смол происходит согласно схеме:
ОН ОН ОН
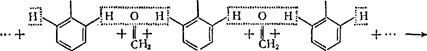
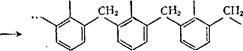
|
| "" + «Н20 |
ОН ОН ОН
фенолоформальдегидиая смола
Процесс сопровождается выделением воды. Фенолоформальдегидные смолы обладают замечательным свойством: при нагревании они вначале размягчаются, а при дальнейшем нагревании (особенно в присутствии соответствующих катализаторов) затвердевают. Из этих смол готовят ценные пластические массы — фенопласты: смолы смешивают с различными наполнителями (древесной мукой, измельченной бумагой, асбестом, графитом и т. п.), с пластификаторами, красителями, и из полученной массы изготовляют методом горячего прессования различные изделия. В последние годы фенолоформальдегидные смолы нашли новые области применения, например производство строительных
деталей из отходов древесины, изготовление оболочковых форм в литейном деле.
Полиэфирные смолы. Примером таких смол может служить продукт поликонденсации двухосновной ароматической терефтале-вон кислоты с двухатомным спиртом этиленгликолем:
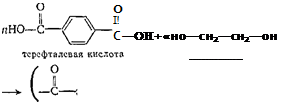

+ mH20
п
полиэтилентерефталат
Полиэтилентерефталат—полимер, в молекулах которого многократно повторяется группировка сложного эфира. В СССР эту смолу выпускают под названием лоесан (за рубежом — терилен, дакрон). Из нее готовят волокно, напоминающее шерсть, но значительно более прочное, дающее несминаемые ткани. Лавсан обладает высокой термо-, влаго- и светостойкостью, устойчив к действию щелочей, кислот и окислителей.
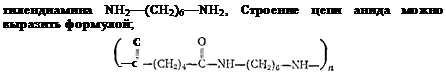
Полиамидные смолы. Полимеры этого типа являются синтетическими аналогами белков. В их цепях имеются такие же, как в белках, многократно повторяющиеся амидные —СО—NH—■ группы. В цепях молекул белков они разделены звеном из одного С-атома, в синтетических полиамидах — цепочкой из четырех и более С-атомов. Волокна, полученные из синтетических смол,—■ капрон, энант и анид — по некоторым свойствам значительно превосходят натуральный шелк. В текстильной промышленности из них вырабатывают красивые прочные ткани и трикотаж. В технике используют изготовленные из капрона или анида веревки, канаты, отличающиеся высокой прочностью; эти полимеры применяют также в качестве основы автомобильных шин, для изготовления сетей, различных технических тканей.
Капрон является поликонденсатом аминокапроновой кислоты, содержащей цепь из шести атомов углерода*
✓° II II
пШ2—(СН2)5—(Г —>--------- NH—(СН2)5—С—NH—(СН2)5—С------- + mH20
Х)Н
амннокапроновая кислота капрон
Энант — поликонденсат аминоэнантовой кислоты, содержащей цепь из семи атомов углерода.
Анид {найлон или перлон) получается поликонденсацией двухосновной аддпиновой кислоты.HQQC—^СНа)!—fiOOH и гексаме*
178. Кремний в природе. Получение и свойства кремния
Натуральные и химические волокна. Все текстильные волокна, применяемые для производства различных видов пряжи, подразделяют на натуральные и химические.
Натуральными — называют волокна, образующиеся в растениях (хлопковое, льняное и другие волокна, состоящие из целлюлозы) или из выделений живых организмов (шерсть, шелковые нити, выделяемые тутовым шелкопрядом, — состоящие из белков).
Химическими — называют все волокна, которые производятся искусственным путем. Их, в свою очередь, подразделяют на искусственные, получаемые при химической переработке природных веществ (главным образом, целлюлозы), и синтетические, — изготовляемые из специально синтезируемых химических материалов (главным образом, синтетических высокополимеров)'.
К искусственным относятся волокна вискозного, ацетатного и медноаммиачного шелка, получаемого переработкой целлюлозы (стр. 480)'. Примерами синтетических волокон служат рассмотренные выше волокна из полимеризационных (хлорин, нитрон) или поликонденсационных (лавсан, капрон, энант, анид) смол.
Производство химических волокон имеет огромное народнохозяйственное значение, развитие его способствует повышению материального благосостояния людей. Оно дает возможность обеспечить постоянно растущую потребность в товарах широкого потребления — различных тканях, изделиях из трикотажа, искусственного меха и т. п. В технике наличие разнообразных химических волокон с определенным комплексом свойств позволяет решать многие важные задачи.
В 1985 г. в нашей стране было произведено 1,4 млн. т химических волокон и нитей; к 1990 г, намечено довести их производство до 1,85 млн. т.
КРЕМНИЙ (SILICIUM)
178. Кремний в природе. Получение и свойства кремния. Крем-1 ний — один из самых распространенных в земной коре элементов. Он составляет 27 % (масс.) доступной нашему исследованию части земной коры, занимая по распространенности второе место после кислорода. В природе кремний встречается только в соединениях* в виде диоксида (двуокиси) кремния Si02, называемого также кремниевым ангидридом или кремнеземом, и в виде солей крем-* ниевых кислот (силикатов)'. Наиболее широко распространены в природе алюмосиликаты, т. е. силикаты, в состав которых входиф, алюминий,)^ ним относятся полевые шпаты, слюды, каолин и др,
Как углерод, входя в состав всех органических веществ, является важнейшим элементом растительного и животного царства, Так кремний — главный элемент в царстве минералов и горных пород.
В большинстве организмов содержание кремния очень невелико. Однако некоторые морские организмы накапливают большие количества кремния. К. богатым им морским растениям относятся диатомовые водоросли, из животных много кремния содержат радиолярии, кремниевые губки.
Свободный кремний можно получить прокаливанием с магнием мелкого белого песка, который представляет собой диоксид кремния:
S Ю2 + 2Mg = 2MgO + Si
При этом образуется бурый порошок аморфного кремния.
Кремний растворим в расплавленных металлах. При медленном охлаждении раствора кремния в цинке или в алюминии кремний выделяется в виде хорошо образованных кристаллов октаэдриче-ской формы. Кристаллический кремний обладает стальным блеском.
Кристаллы кремния высокой чистоты, имеющие минимальное число дефектов структуры, характеризуются очень низкой электрической проводимостью. Примеси и нарушения правильности строения резко увеличивают их проводимость.
Кремний применяется главным образом в металлургии и в полупроводниковой технике. В металлургии он используется для удаления кислорода из расплавленных металлов и служит составной частью многих сплавов. Важнейшие из них—-это сплавы на основе железа, меди и алюминия. В полупроводниковой технике кремний используют для изготовления фотоэлементов, усилителей, выпрямителей. Полупроводниковые приборы на основе кремния выдерживают нагрев до 250°С, что расширяет область их применения.
В промышленности кремний получают восстановлением диоксида кремния коксом в электрических печах:
SiOs + 2C = Si+2COT
Полученный по этому способу кремний содержит 2—5 % примесей. Необходимый для изготовления полупроводниковых приборов кремний высокой чистоты получают более сложным путем. Природный кремнезем переводят в такое соединение кремния, которое поддается глубокой очистке. Затем кремний выделяют из полученного чистого вещества термическим разложением или действием восстановителя. Один из таких методов состоит в превращении кремнезема в хлорид кремния S1CU, очистке этого продукта и восстановлении из него кремния высокочистым цинком, Весьма чйстый кремний можно получить также термическим разложением иодида кремния Sil4 или силана SiH4. Получающийся кремний содержит весьма мало примесей и пригоден для изготовления некоторых полупроводниковых приборов. Для получения еще более чистого продукта его подвергают дополнительной очистке, например зонной плавке (см. § 193).
В химическом отношении кремний, особенно кристаллический, малоактивен; при комнатной температуре он непосредственно соединяется только с фтором. При нагревании аморфный кремний легко соединяется с кислородом, галогенами и серой.
Кислоты, кроме смеси фтороводорода и азотной кислоты, не действуют на кремний, но щелочи энергично реагируют с ним, выделяя водород и образуя соли кремниевой кислоты H2SiC>3:
Si + 2КОН + Н20 = K2Si03 + 2H2f
В присутствии следов щелочи, играющей роль катализатора, кремний вытесняет водород также из воды.
Если накаливать в электрической печи смесь песка и кокса, взятых в определенном соотношении, то получается соединение кремния с углеродом — карбид кремния SiC, называемый карборундом:
Si02 + 3C= SiC + 2COf
Чистый карборунд — бесцветные очень твердые кристаллы (плотность 3,2 г/см3). Технический продукт обычно окрашен примесями в темно-серый цвет.
По внутреннему строению карборунд представляет собой как бы алмаз, в котором половина атомов углерода равномерно заменена атомами кремния. Каждый атом углерода находится в центре тетраэдра, в вершинах которого расположены атомы кремния; в свою очередь каждый атом кремния окружен подобным же образом четырьмя атомами углерода. Ковалентные связи, соединяющие все атомы в этой структуре, как и в алмазе, очень прочны. Этим объясняется большая твердость карборунда.
Карборунд получают в больших количествах; применение его разнообразно и связано с его высокой твердостью и огнеупорностью. Из порошка карборунда изготовляют шлифовальные круги, бруски, шлифовальную бумагу. На его основе производят плиты для сооружения полов, платформ и переходов в метро и на вокзалах. Из него готовят муфели и футеровку для различных печей. Смесь порошков карборунда и кремния служит материалом для изготовления силитовых стержней для электрических печей.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 397; Нарушение авторских прав?; Мы поможем в написании вашей работы!