
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 23 страница
|
|
|
|
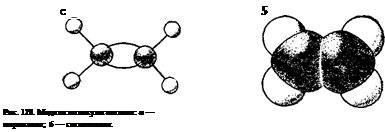
Природа кратных углерод-углеродных связей несколько иная. Так, в молекуле этилена при образовании двойной ковалентной связи С = С (или С::С) в каждом из атомов углерода в гибридизации участвует одна s-орбиталь и только две р-орбнтали (sp2-гибридизация); одна из р-орбиталей каждого атома С не гибриди-зуется. В результате образуются три 5р2-гибридных электронных облака, которые участвуют в образовании трех о-связей. Всего в молекуле этилена пять а-связей (четыре С—Н и одна С—С); все они расположены в одной плоскости под углами около 120° друг к другу (рис. 125).
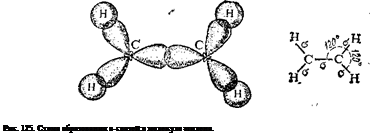
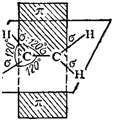
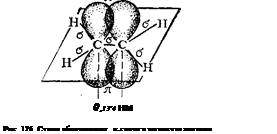
Таким образом, одна из электронных пар в связи С=С осуществляет а-связь, а вторая — образуется р-электронами, не участвующими в гибридизации; их облака сохраняют форму объемной восьмерки («гантели»), ориентированы перпендикулярно к плоскости, в которой расположены а-связи, и перекрываются над и под этой плоскостью (рис. 126), образуя л-связь (см. § 42).
 | |||
 | |||
Следовательно, двойная связь С = С представляет собой сочетание одной а- и одной я-связей.
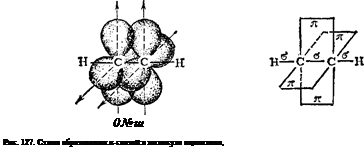
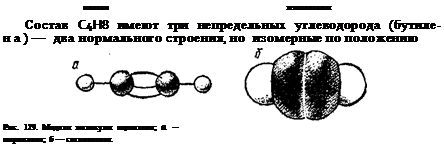
Тройная связь С = С (или С •• С) является сочетанием одной с-связи и двух я-связей. Например, при образовании молекулы ацетилена в каждом из атомов углерода в гибридизации участвует одна s-орбнталь и только одна р-орбиталь (sp-гибридизация); в результате образуются два sp-гибридных электронных облака, участвующих в образовании двух а-связей. Облака двух р-элек-тронов каждого атома С не гибридизуются, сохраняют свою конфигурацию и участвуют в образовании двух я-связей. Таким образом, в ацетилене всего три а-связи (одна С—С и две С—Н), направленные вдоль одной прямой, и две я-связи, ориентированные в двух взаимно перпендикулярных плоскостях (рис. 127).
|
|
|
Кратные (т. е. двойные и тройные) связи при реакциях легко превращаются в простые; тройная вначале переходит в двойную, а последняя — в простую. Это обусловлено их высокой реакционной способностью и имеет место при присоединении каких-либо атомов к паре атомов углерода, связанных кратной связью.
Переход кратных связей в простые объясняется тем, что обычно л-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с р-связями. При образовании я-связей р-электронные облака с параллельными осями перекрываются в значительно меньшей степени, чем электронные облака, перекрывающиеся по оси связи (т. е. гибридные, s-электронные или ориентированные вдоль оси связи электронные облака),
Кратные связи прочнее простых. Так, энергия разрыва связи С = С составляет 535 кДж/моль, связи С = С — 423 кДж/моль, а связи С—С только 264 кДж/моль.
Из.сказанного следует, что в формулах две черточки из трех в связи С = С и одна черточка из двух в связи С = С выражают связи менее прочные, чем простая связь С—С.
На рис. 128 и 129 представлены шариковые и сегментовые пространственные модели соединений с двойной (этилен) и с тройной (ацетилен) связями.
4. Теория строения объяснила многочисленные случаи изомерии органических соединений.
Цепи из атомов углерода могут быть неразветвленными или разветвленными:
МММ МММ
—с—с—с—с—с—с— —с—с—с—с—с-с—
МММ МММ

Так, состав С5Н12 имеют три предельных углеводорода (пента-на) с различным строением цепей — один с неразветвленной цепью (нормального строения) и два с разветвленной (изо-строения):
СН3 СН3
I I
СН3—СН2—СН2—СН2—СН, СН3—СН—СНа—СНз сн3—с—сн3
I
 сн3
сн3
двойной связи и один — изостроения:
СНз
СНз=СН—СНз—СНз СНз—СН=СН—СН3 СН2=С—СН3
бутилены изобутнлен
Этим непредельным соединениям изомерны два циклических углеводорода, также имеющие состав С4Н8 и изомерные друг другу по величине цикла:
|
|
|
Н2С—СН2 СН2
II /\
Н2С—СН2 Н2С СН—СН3
циклобутан метилциклопропан
При одном п том же составе соединения могут различаться по строению вследствие различного положения в углеродной цепи и других, не углеродных, атомов, например:
СН3—СН2—СН2 СН3—СН—СН3
I I
Вг Вг
изомеры пропилбромида С3Н7ВГ
СН3—СНа—ОН CHj—О—СНз
этплогшП спирт С2КуО диметплозый эфпр С2ЧзО
Изомерия может быть обусловлена не только различным порядком соединения атомов. Известно несколько видов пространственной изомерии (с т е р е о и з о м е р и и), заключающейся в том, что соответствующие изомеры (с т е р е о н з о м е р ы) при одинаковом составе и порядке соединения атомов отличаются различным расположением атомов (или групп атомов) в пространстве.
Так, если в соединении имеется атом углерода, связанный с четырьмя разными атомами или группами атомов (асимметрический атом*), то возможны две пространственно-изомерные формы такого соединения. На рис. 130 представлены две тетра-эдрические модели молочной кислоты СН3—*СН—COOH, в которых
I
ОН
| * Наличие такого атома приводит к асимметрии молекул; очевидно, что обе модели на рие. 130 несимметричны — ни через одну из них невозможно провести плоскость симметрии. |
асимметрический атом углерода (он в формуле помечен звездочкой) находится в центре тетраэдра. Нетрудно заметить, что эти модели невозможно совместить в пространстве: они построены зеркально и отображают пространственную конфигурацию молекул двух различных веществ (в данном примере молочных кислот), отличающихся некоторыми физическими, а главным образом, биологическими свойствами. Такая изомерия называется зер-
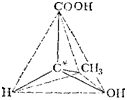 | 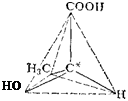 | ||
Рис. ISO. Тетраздрнческие модели молекул зеркальных изомероз молочной кислоты.
к а л ь н о й стерео изомерией, а соответствующие изомеры —■ зеркальными изомерами*. Различие в пространственном строении зеркальных изомеров может быть представлено и при помощи структурных формул, в которых показано различное расположение атомных групп при асимметрическом атоме; например, для приведенных на рис. 130 зеркальных изомеров молочной кислоты:
Н-
СООН
|
|
|
I
-С*—ОН
I
СНз
соон
I
но—с*—н
!
сн3
Как уже указано, атомы углерода; соединенные двойной связью, лежат в одной плоскости с четырьмя связями, соединяющими их с другими атомами; углы между направлениями этих связей приблизительно одинаковы (рис. 126). Когда с каждым из атомов углерода при двойной связи соединены различные атомы или группы, возможна так называемая геометрическая сте-реоизомерия, или цис-траяс-я з о м е р и я. Примером могут служить пространственные геометрические изомеры дихлорэтилена СНС1 = СНС1:
Hn
/
С1
С
с
н/ \ci
ггис-дпхлооэтплен (темп. кип. 60 °С)
С
ci/ ^н
тракс-дихлорэтнлен (темп. кип. 48 °С)
| * Стереоизомеры с асимметрическими атомами, в том числе и зеркальные, различаются по оптическим свойствам, а именно по влиянию на пропускаемый через них поляризованный свет; поэтому их называют также оптическими изомерами (см. в учебниках органической химии), |
В молекулах одного изомера атомы хлора расположены по одну сторону двойной связи, а в молекулах другого — по разные стороны. Первая конфигурация называется цис-, вторая — транс-конфигурацией. Геометрические изомеры отличаются друг от друга по физическим и химическим свойствам. Существование их обусловлено тем, что двойная связь исключает возможность свободного вращения соединенных ею атомов вокруг оси связи (такое вращение требует разрыва я-связи; см. рис. 126).
5. Взаимное влияние в молекулах органических веществ проявляют прежде всего атомы, непосредственно связанные друг с другом. В этом случае оно определяется характером химической связи между ними, степенью различия в их относительной электроотрицательности и, следовательно, степенью полярности связи.
Например, если судить по суммарным формулам, то в молекуле метана (СН4) и в молекуле метилового спирта (СН40) все четыре атома водорода должны обладать одинаковыми свойствами. Но, как будет показано дальше, в метиловом спирте один из атомов водорода способен замещаться щелочным металлом, тогда как в метане атомы водорода такой способности не проявляют. Это объясняется тем, что в спирте атом водорода непосредственно связан не с углеродом, а с кислородом
|
|
|
н
н->с<-н
н
н->с->о<-н
В приведенных структурных формулах стрелками на черточках связей условно показано смещение пар электронов, образующих ковалентную связь, вследствие различной электроотрицательности, атомов. В метане такое смещение в связи Н->-с невелико, поскольку электроотрицательность углерода (2,5) лишь незначительно превышает электроотрицательность водорода (2,1) (табл. 6, стр. 118). При этом молекула метана симметрична. В молекуле же спирта связь о-<-Н значительно поляризована, поскольку кислород (электроотрицательность 3,5) гораздо больше оттягивает на себя электронную пару; поэтому атом водорода, соединенный с атомом кислорода, приобретает большую подвижность, т. е. легче отрывается в виде протона.
В органических молекулах имеет значение также взаимное влияние атомов, не связанных друг с другом непосредственно. Так, в метиловом спирте под влиянием кислорода увеличивается реакционная способность не только атома водорода, связанного с кислородом, но и атомов водорода, непосредственно с кислородом не связанных, а соединенных с углеродом. Благодаря этому метиловый спирт довольно легко окисляется, тогда как метан относительно устойчив к действию окислителей. Это объясняется тем,, что кислород гидроксильной группы значительно оттягивает на
себя пару электронов в связи С-»-0> соединяющей его с углеродом, электроотрицательность которого меньше. В результате эф-
163. Классификация органических соединений
фектнвный заряд атома углерода становится более положительным, что вызывает дополнительное смещение пар электронов также и в связях Н—>-С в метиловом спирте, сравни» тельно с теми же связями в молекуле метана. При действии окислителей атомы Н, связанные с тем же атомом углерода, с которым связана группа ОН, значительно легче, чем в углеводородах, отрываются и соединяются с кислородом, образуя воду. При этом атом углерода, связанный с группой ОН, подвергается дальнейшему окислению (см. § 171).
Взаимное влияние атомов, непосредственно друг с другом не связанных, может передаваться на значительное расстояние по цепи атомов углерода и объясняется смещением плотности электронных облаков во всей молекуле под влиянием имеющихся в ней различных по электроотрицательности атомов или групп. Взаимное влияние может передаваться и через пространство, окружающее молекулу, — в результате перекрывания электронных облаков сближающихся атомов.
163. Классификация органических соединений. В зависимости от строения углеродных цепей, среди органических соединений выделяют следующие три ряда.
Соединения с открытой цепью атомов углерода, называемые также ациклическими, или соединения жирного ряда*. В зависимости от характера связей между атомами углерода, эти соединения подразделяют на предельные (или насыщенные), содержащие в молекулах только простые (ординарные) связи, и непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода.
Соединения с замкнутой цепью атомов углерода, или к а р б о ц и к л и ч е с к и е. Эти соединения в свою очередь подразделяются на:
а) соединения ароматического ряда; они ха-
рактеризуются наличием в молекулах особой циклической груп-
пировки из шести атомов углерода — бензольного арома-
тического ядра. Эта группировка отличается характером
связей между атомами углерода и придает содержащим ее сое-
динениям особые химические свойства, называемые ароматиче-
скими свойствами (см. § 167).
б) ал и циклические соединения — все остальные
карбоцнклические соединения. Они различаются по числу атомов
углерода в цикле и, в зависимости от характера связей между
этими атомами, могут быть предельными или непредельными.
| * Последнее название возникло исторически: к первым изученным соединениям с длинными незамкнутыми углеродными цепями принадлежали кислоты, входящие в состав жиров. |
Гетероциклические соединения. В молекулах этих соединений имеются циклы, включающие, кроме атомов углерода,
также гетер о а то мы, т. е. атомы других элементов (кислорода, азота, серы и др.).
Соединения каждого из указанных рядов подразделяются на классы.
В рядах ациклических (жирных) и карбоциклических соединений простейшими являются углеводороды, состоящие только из углерода и водорода. Все остальные соединения этих рядов рассматривают как производные углеводородов, образованные замещением одного, двух или нескольких атомов водорода в углеводородной молекуле другими атомами или группами атомов *.
Остатки углеводородов, образующиеся при отнятии от их молекул одного, двух или нескольких атомов водорода, называют углеводородными радикалами; одновалентные радикалы обозначают символом R—, двухвалентные — символом —R-—:
^или R\Q, трехвалентные — символом — R<
Атомы или группы атомов, замещающие водород в углеводородной основе, образуют функциональные, или х ар акте» р и с т и ч е с к и е **, группы, обусловливающие общие химические свойства веществ, принадлежащих к одному и тому же классу производных углеводородов. Ниже приведены общие формулы и названия некоторых классов органических соединений (в скобках— формулы и названия функциональных групп).
Галогенпронзводные углеводородов
R—F R-—CI R—Br R—I
фторпроиззодные хлорпропзводные бромпроиззодные иодпроязводиые
Кислородсодержащие соединения
R—ОН
спирты и фенолы (—ОН — спиртозая или фенольная гпдроксильная группа)
R—О—R или R-O-R'
простые Эфиры
О
,0
О
R—С
или R—С
R—С
-R'
Х)Н
 альдегиды
альдегиды
о-°-
кетоны карбонильная труп:
карбомовые кислоты
■карбоксильная группа
)

R—С; пли R—С R—С
^OR ^OR' \d R—С—О—С—R
сложные эфиры хлорапглдрнды ангидриды кислот
кислот
Азотсодержащие соединения
R R
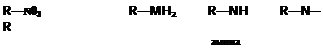
питросоединения амины
(—NOj — нитрогруппа)
/
Серусодержащис соединения
R—SH R—S—R R—s02OH
тиоспиргы и тиозфпры или сульфо-
ткофенолы сульфиды кислоты
(—Si i — сульфгидрильная (—S02OH —судьфогруппа)
пли меркаптогруппа)
Э л е м е н т о р г а н и ч е с к и е соединения
а) Металлортапические соединения*
i п R\iii R\iv/^
R—М R—М—R \М—R bY
R/ W ^R
б) Кремкийорганические соединения
Rx Rx /R
R—SiH3 R—SiH2—R)SiH—R)sr
W W ^R
Возможны соединения с повторяющимися одинаковыми функциями:
°Ч ^°
НО—R—ОН R—С—R'— С—R,С—R—С
I! I! НО/ \0н
о о
дзухатомные дикетоны дзухосновные
спирты кислоты
Вещества, в которых имеются различные функциональные группы, называются соединениями со смешанными функциями, например:
H2N—R—OH HO—R—С H2N-R-C^
аминоспирты гидрокеикислоты аминокислоты
| i н iii iv * М, М, М, М — одно-, двух-, трех-, четырехвалентные металлы, |
(спиртокислоты)
Соединения со смешанными функциями обладают двойственной природой. Например,аминокислоты проявляют одновременно свойства и аминов, и кислот, но и те и другие свойства несколько изменяются вследствие взаимовлияния функциональных групп.
Классы органических веществ весьма разнообразны; ниже вкратце рассмотрены лишь важнейшие из них.
164. Предельные (насыщенные) углеводороды*. Простейший представитель класса предельных углеводородов — метан СН4. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Температура его кипения равна —161,5°С, температура затвердевания —182,5°С.
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97 %), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1: 10).
Молекула метана характеризуется сравнительно большой прочностью. При обычных условиях метан активно (со взрывом) реагирует с фтором, очень медленно взаимодействует с хлором и почти не реагирует с бромом. Реакция с хлором или бромом ускоряется под действием света, а также при нагревании и заключается в последовательном замещении атомов водорода атомами галогена с образованием галоген производных, например:
СН4 + СЬ ■—> СН3С1 + НС1
метилхлорид (хлорметан)
СН3С1 + С12 —> СН2С12 + НС1 и т. д.
дихлорметан
| * По правилам систематической номенклатуры ИЮПАК предельные углеводороды называются а л к а н а м и. Часто встречается и их старое название — парафины, — которое происходит от латинских слов parum affinitatis — лишенные сродства — и отражает исключительную неактивность этих углеводородов в реакциях. |
Метан горит синеватым или почти бесцветным пламенем, выделяя большое количество теплоты (879 кДж/моль). Однако при обычных условиях он не окисляется раствором перманганата калия (фиолетовая окраска раствора КМп04 при контакте с предельными углеводородами не исчезает).
Как уже было указано, метан — первый представитель гомоло-
гического ряда предельных или насыщенных углеводородов:
СН4 С2Нб С3Н8 С4Н10 С5Н12 СбН14 ••• С10Н22 и т. д.
метан этан пропан бутан пентан гексан декан
В молекулах этих соединений все связи между атомами углерода простые (ординарные), атомы углерода максимально, до предела «насыщены» водородом. Состав любого из гомологов отвечает общей формуле CnH2n+2 (гДе п — число атомов углерода); эта закономерность дает возможность написать формулу состава для предельного углеводорода с любым числом С-атомов, например Ci8H38 (октадекан), Ci00H2o2 (гектан).
Состав одновалентных радикалов, получаемых отнятием атома водорода от молекулы предельного углеводорода, выражает формула C„H2n+i—. Названия их образуются заменой окончания -ан в названии углеводорода окончанием -ил. Так, от метана производится метил СН3—, от этана — этил С2Н5—, от пропана — пропил С3Н7— и т. д.
Как и в других гомологических рядах, в ряду метана проявляется всеобщий закон природы — закон перехода количественных изменений в качественные. Изменение состава молекулы на группу СН2 каждый раз приводит к новому веществу, которое хотя и имеет много общего с соседними членами ряда, но вместе с тем по некоторым свойствам отличается от них. Различие гомологов ясно проявляется в их физических свойствах. Низшие члены ряда предельных углеводородов (от СН4 до С4Ню)—газы; средние члены (от С5Н12 до Ci6H34) при температуре до 20 °С — жидкости, остальные при обычных условиях находятся в твердом состоянии. Во всех случаях температуры кипения и затвердевания тем выше, чем больше молекулярная масса углеводорода.
В то же время предельные углеводороды в химическом отношении подобны метану. Они весьма инертны, вступают лишь в реакции замещения водорода, протекающие крайне медленно, и Не обесцвечивают на холоду растворы брома и перманганата калия.
Все предельные углеводороды горят и могут быть использованы в качестве топлива. Они входят в состав нефтей и продуктов Их перегонки. При фракционной перегонке нефть разделяют на отличающиеся по температурам кипения фракции | «погоны») и получают следующие нефтепродукты:
а) бензины (темп. кип. 40—180°С) содержат углеводороды
От С5Н]2 до С10Н22; при повторной перегонке из них могут быть
Выделены легкие нефтепродукты, кипящие в более узких пределах:
Нетролейный эфир (40—70°С), авиационный бензин (70—100 °С),
hero'мобильный бензин (100—120 °С);
б) керосины (темп. кип. 180—270°С)" содержат углеводоро-.
ды от СюН22 до С]6Н34;
в) соляровые масла (темп. кип. 270—360°С) содержат
смеси углеводородов от С12 До С20; из них получают смазочные
масла и различные виды дизельного топлива;
г) мазут (нефтяные остатки — до 40—50 %) содержит еще
более тяжелые (высшие) углеводороды; из мазута получают тяже-
лые смазочные масла, вазелин, парафин.
Как уже было указано, с увеличением числа С-атомов в молекулах резко возрастает число изомеров предельных углеводородов. Метан СН4, этан СгНб и пропан С3Н3 не имеют изомеров; 7 бутанов С4Н10 существует два:
СН3
СИз-СН2-СН2— СН3
СНз—СН—СН3
бутан (темп. кип. — 0,5 °С; темп, плавл. —133,4 °С)
изобуган (темп. кип. — 11,7 °С; темп, плавл. — 159,6 °С)
Изомерных пентанов С5И12 — три, гексанов C6Hi4 — пять, геп-танов С7Н]6 — девять, октанов CsH18—18, нонанов С9Н20 — 35. Все эти углеводороды получены. Деканов С10Н22 может быть 75, а формулу С15Н32 могут иметь уже 4347 изомерных углеводородов. Для высших гомологов пока известны лишь некоторые изомеры, однако принципиальная возможность их существования предсказана и доказана А. М. Бутлеровым; им был осуществлен первый синтез углеводорода с разветвленной цепью — изобутана.
Как отдельные гомологи, так и изомеры отличаются друг от друга не только физическими, но и химическими свойствами. Сильная разветвленность углеродной цепи часто приводит к повышению температур замерзания, и высокое содержание таких углеводородов в бензинах может ограничивать возможность использования последних в зимних условиях.
Различие в химических свойствах сказывается, в частности, на склонности некоторых углеводородов, входящих в состав моторного топлива, к детонации.
Детонация моторного топлива представляет собой чрезвычайно быстрое разложение (взрыв) углеводородов, которое происходит внезапно при сжатии горючей смеси в цилиндре двигателя. Детонация не дает возможности достигнуть высокой степени сжатия горючей смеси *, ведет к излишнему расходу топлива и быстрому износу мотора. Детонационные свойства топлива зависят от строения углеродных цепей в молекулах углеводородов, входящих в его состав. Изомеры с сильно разветвленной цепью детонируют гораздо труднее, чем изомеры с неразветвленной цепью.
| * Увеличение степени сжатия повышает мощность двигателя, |
Антидетонационные свойства моторного топлива характеризуют так называемым октановым числом (о.ч.). В качестве стандартных образцов для определения октанового числа берут угле-.
водород гептан С7Н16 с неразветвленной цепью атомов, весьма легко детонирующий, и один из изомеров октана (изооктан), с раз-, ветвлекпой цепью атомов, мало склонный к детонации:
СН3-СН2-СН2-СН2-СН2—СН2—CHS
гептан
СН3 СН8
I I
сн3—С—сн2—СМ—сн3
!
СН,
изооктан
Октановое число гептана принимается равным нулю, а изоок-тану приписывается о. ч. 100. Если о. ч. топлива равно 80, то это значит, что данный вид топлива детонирует в смеси с воздухом (при такой же степени сжатия), как смесь, состоящая из 80 % изооктаиа и 20 % гептана.
Повышение октанового числа топлива достигается увеличением содержания в нем углеводородов с разветвленной цепью атомов, а также прибавлением антидетонаторов, обычно тетраэтил-свинца, небольшое количество которого значительно снижает детонацию.
Тетраэтилсвинец (ТЭС, «этиловая жидкость») представляет собой тяжелую ядовитую жидкость, строение молекул которой выражается формулой:
СН3—СН2Ч /СН2— СНз
)рь(
СНз—CIV СН2—СН3
Тетраэтилсвинец относится к металлорганическнм соединениям— веществам, в которых углеводородные радикалы непосредственно соединены с атомом какого-нибудь металла. Эти вещества находят все более широкое применение.
165. Непредельные (ненасыщенные) углеводороды. Простейший непредельный углеводород с двойной связью — этилен С2Н4 или СН2=СН2, как уже указывалось, является родоначальником гомологического ряда непредельных этиленовых* углеводородов:
С2Н4 С3Нб С4Н8 С5Н10 С6Н12 ••• С10Н20 и т. д.
этилен пропилен бутилен амилен гексилен дгцплен
| * Раньше этиленовые углеводороды называли также олефинами, а углеводороды с двумя двойными связями — д и э т и л е н о в ы м и, или диоле-ф и н а м и. По систематической номенклатуре ИЮПАК углеводороды ряда этилена называют а л к е и а м и, с двумя двойными связями — а л кади ен а-, ни, а ацетиленовые — а л к и н а м и. |
Состав любого углеводорода этого ряда выражает общая формула С„Н2„ (где п — число атомов углерода).
Состав членов гомологического ряда непредельных ацетиленовых* углеводородов (с тройной связью), родоначальником которых является ацетилен С2Нг, или СН = СН, выражается общей
фОрМуЛОЙ СН.2Л-2-
Общая формула С„Н2я_2 выражает также состав углеводородов с двумя двойными связями*; из них отметим бутадиен (или дивинил) С4Н6 и изопрен С5Н8, имеющие следующее строение:
СН3
си2=сн—сн=сн2 си2=с—сн=сн2
бутадиен (дивинил) изопрен
Известны углеводороды с большим числом двойных (по л пеоны) или тройных (полиины) связей.
Непредельные углеводороды могут быть получены из предельных путем каталитического отщепления водорода (реакция де«гидрирования, или дегидрогенизации). Например, из содержащегося в попутном нефтяном газе этана получают этилен, а из бутана — бутадиен:
CHj-CH,
катализатор
->■ СН,=СН,
-Н2
сн3
-сн2—сн2-
бутан
-сн3
катализатор
--------- >-
—2Н2
СН2:
=сн—сн=сн2
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 449; Нарушение авторских прав?; Мы поможем в написании вашей работы!