
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции комплексообразования
|
|
|
|
Задачи для самостоятельного решения.
1. Вычислите произведение растворимости сульфата бария, если в 1 л насыщенного раствора содержится 0,0025 г BaSO4.
Ответ:1×10- 10 .
2. Найдите произведение растворимости оксалата серебра, если растворимость его равна 3,027×10- 3 моль/л.
Ответ:5 ×10- 12.
3. Рассчитайте молярную растворимость CaC2O4 в воде, если произведение растворимости равно 2,57×10-9.
Ответ: 5,07×10-5М.
4. Вычислите произведение растворимости хромата серебра, зная, что в 100 мл насыщенного раствора его содержится 0,002156 г.
Ответ:1,1 ×10- 12.
5. Вычислите растворимость соли в граммах на литр:
а) без учёта и b) с учетом коэффициентов активности, если произведение растворимости хлорида свинца равно 1, 6× 10-5.
Ответ:a) 4,45 г/л; b)6,62 г/л.
6. Найдите растворимость BaСO3, если произведение растворимости равно 4,0×10- 10.
Ответ: 2×10- 5 М.
7. Вычислите растворимость хлорида серебра в 0,01 М растворе KCl, если произведение растворимости его равно 1,78×10- 10.
Ответ:2.2×10-8 М.
8. Выпадет ли осадок гидроксида кобальта, если смешать равные объемы Со(NO3)2 (С= 2×10- 5) моль/л и NaOH
(С= 4×10- 3) моль/л, если произведение растворимости равно 6,3×10- 15 ?
9. При какой величине рН начнется осаждение гидроксида алюминия из 0,1 М раствора его соли Al(NO)3 при действии NH4OH
Ответ: рН3,4.
10.При какой величине рН осаждения гидроксида алюминия будет практически полным?
Ответ:рН5,4.
11.Рассчитать рН начала и конца осаждения гидроксида хрома, если концентрация ионов Cr 3+ в растворе равна 2 ∙10-2М.
Ответ: рНН.О. 4,48; рН К.О. 5,91.
Комплексные соединения – это частицы, образованные двумя или большим числом более простых частиц (ионов, молекул), способных к самостоятельному существованию в растворе. Молекулы комплексных соединений состоят, как правило, из внешней и внутренней сфер. Диссоциация по внешней сфере протекает в большинстве случаев полностью, например,
|
|
|
[Ag(NH3)2 ] Cl ® [ Ag(NH3)2]+ + Cl-.
Внутренняя сфера комплексного иона или молекулы состоит из одного или нескольких центральных атомов или ионов (комплексообразователей), вокруг которых координируются ионы или молекулы (лиганды). Координационное число показывает, сколько лигандов непосредственно связано с комплексообразователем.
В аналитической практике наиболее часто встречаются со следующими комплексными соединениями:
1) ацидокомплексы – соединения, в которых роль лигандов выполняют кислотные остатки, например, K4[Fe(CN)6], Na3[Co(NO2)6], Na3[FeF6];
2) гидроксокомплексы – соединения, в которых роль лигандов принадлежит ионам гидроксила, например, Na3[Al(OH)6], Na2[Zn(OH)4];
3) аммиакаты – комплексные соединения, в состав которых входят молекулы аммиака, например, [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2;
4) аквакомплексы – соединения, содержащие во внутренней сфере молекулы воды, например,[Al(H2O)6]Cl3, [Co(H2O)6]Cl3;
5) внутрикомплексные соединения не имеют внешней сферы и их частицы не несут зарядов, например [Сu(NH2CH2COO)2]0.
Уравнение реакции образования комплексного соединения в растворе имеет вид:
Me + n L⇆ MeL n,
где комплексообразователь Ме (обычно это ион металла) образует с лигандом L комплекс MeL n. Согласно ЗДМ, константа равновесия данной реакции:
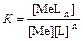 .
.
называется константой устойчивости комплекса или константой образования.
Процесс образования и диссоциации комплексных соединений протекает ступенчато:
Me + L⇆ MeL 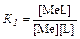
MeL + L⇆MeL2 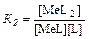
..................
MeL n -1 + L⇆ MeL n 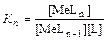 ,
,
-----------------------------------------------------------------------
Me + n L⇆ MeLn , 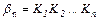
где K 1, K 2, …, Кn - константы ступенчатого комплексообразования,
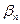 - суммарная константа комплексообразования (устойчивости). Константа нестойкости (Кн) характеризует процесс диссоциации комплексных соединений.
- суммарная константа комплексообразования (устойчивости). Константа нестойкости (Кн) характеризует процесс диссоциации комплексных соединений.
|
|
|
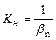 - константа нестойкости суммарного процесса.
- константа нестойкости суммарного процесса. 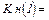
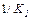 ,
,
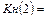
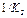 и т.д.- константы нестойкости ступенчатых процессов.
и т.д.- константы нестойкости ступенчатых процессов.
Комплексные соединения применяются в анализе для обнаружения ионов, «маскировки», растворения и образования осадков, для количественного определения веществ (методы комплексометрического титрования, спектрофотометрические методы и др). Зная 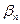 , Кн можно вычислить концентрацию частиц, на которые диссоциирует комплексный ион и решать ряд других аналитических вопросов.
, Кн можно вычислить концентрацию частиц, на которые диссоциирует комплексный ион и решать ряд других аналитических вопросов.
Пример1. Рассчитайте равновесную концентрацию ионов Ag+ в растворе [Ag(NH3)2]NO3, концентрация которого 0,1 моль/л.
Решение: Комплексная соль[Ag(NH3)2]NO3 диссоциирует как сильный электролит:
[Ag(NH3)2]NO3→ [Ag(NH3)2]+ + NO3-
Комплексный ион диссоциирует по типу слабых электролитов:
[Ag(NH3)2]+ ⇆ Ag+ + 2NH3
0,1
0,1-x x 2x
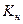 =
= 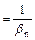 =
= 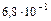
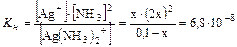
Так как х<<0,1 то 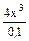 =
= 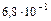
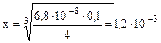
Ответ: [Ag+]=1,2.10-3 моль/л.
Вопросы для самоконтроля:
1. Назовите основные признаки комплексного соединения.
2. Что такое координационное число?
3. Назовите основные типы комплексных соединений. Приведите примеры.
4. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
5. Что такое ступенчатые константы комплексообразования и что они характеризуют?
6. Приведите примеры использования комплексных соединений для маскирования мешающих ионов.
7. Приведите примеры использования комплексных соединений для обнаружения и разделения ионов.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 1923; Нарушение авторских прав?; Мы поможем в написании вашей работы!