
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия растворения и осаждения осадков
|
|
|
|
Пользуясь правилом произведения растворимости, можно по концентрациям реагирующих веществ рассчитать возможность образования и растворения осадков, количество осадителя, необходимое для выделения осадка, значение рН начала и конца осаждения малорастворимых гидроксидов и др. В ненасыщенном растворе:
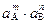 < ПР.
< ПР.
В контакте с таким раствором твердая фаза будет растворяться, пока не установится равновесие:
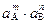 = ПР.
= ПР.
В пересыщенном растворе:
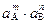 > ПР.
> ПР.
Если такой раствор привести в контакт с кристаллами вещества, то начнется немедленное выпадение осадка до тех пор, пока также не установится равновесие:
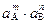 = ПР.
= ПР.
Пример 3. Выпадет ли осадок при смешивании равных объемов 0,001 М растворов CaCl2 и Na2SO4?
Решение: При смешивании растворов общий объем увеличивается вдвое и концентрация каждого из веществ уменьшится вдвое. Концентрации ионов Ca2+ и SO42- соответственно в первый момент после смешивания растворов равны 5∙10-4моль/л.
Для того, чтобы определить выпадет ли осадок CaSO4 необходимо найти произведение концентраций ионов и сравнить его с величиной произведения растворимости 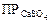 =2,5∙10-5,
=2,5∙10-5,
[Ca2+]∙[ SO42-]=(5∙10-4)2=2,5∙10-9<2,5∙10-5,
следовательно, осадок CaSO4 не образуется.
При использовании в анализе амфотерности гидроксидов необходимо знать интервал рН, в котором происходит образование и полное осаждение их. При выделении в осадок гидроксидов металлов осадителем является гидроксид-ион, поэтому для любого малорастворимого гидроксида будет справедливо равновесие:
Mеm+ + mOH- D Mе(OH)m
ПР= 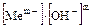
Концентрация иона ОН- должна удовлетворять достижению произведения растворимости гидроксида металла при заданной концентрации иона Mеm+:
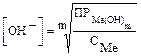 .
.
Следовательно, водородный показатель в момент начала осаждения гидроксида должен удовлетворять условию:
|
|
|
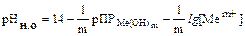 .
.
При расчете рН начала осаждения гидроксида величину [Me m +] приравнивают к концентрации иона металла в растворе. В качественном и количественном химическом анализе осаждение считается полным, если остаточное содержание ионов металла в растворе не превышает 10-6 М. Поэтому при расчете рН полного осаждения гидроксида принимают [Me m +] = 1×10-6 М, т.е.
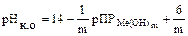
Пример4. При какой величине pH начинается осаждение гидроксида цинка из 0,1 Мраствора его соли, если ПР Zn (OH) 2 =7,1∙10-18.
Решение: Из уравнения Zn(OH)2 D Zn2+ + 2ОН- можно вычислить
[ОН-], рОН и рН, при котором достигается произведение растворимости и начинается осаждение гидроксида цинка Zn (ОН)2:
|
Найдем концентрацию гидроксид-ионов:
[ОН-] = 
 (моль/л)
(моль/л)
По концентрации [ОН-] находим величину pOH:
pOH= - lg [ОН-]= - lg 8,42 ∙ 10-9 =8,08
Зная величину pOH, находим pH:
pHН.О.= 14 – pOH = 14 – 8,08 = 5,92≈ 5,9
Итак, осаждение гидроксида цинка Zn(OH)2 из 0,1 М раствора соли цинка начинается при pH 5,9.
Пример 5. При какой величине pH осаждение гидроксида цинка будет практически полным?
Решение: Из уравнения произведения растворимости гидроксида цинка Zn(OH)2 находим концентрацию [ОН-]:
[ОН-] = 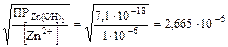 (моль/л)
(моль/л)
По концентрации [ОН-] находим величину pOH:
pOH= - lg [ОН-]= - lg 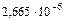 =5,57
=5,57
Зная величину pOH, находим pH конца осаждения:
pHК.О. = 14 – pOH = 14 – 5,57 = 8,43
Итак, осаждение гидроксида цинка будет практически полным при
рН 8,43.
Вопросы для самоконтроля:
1. Для каких систем применимо правило произведения растворимости?
2. Что такое растворимость малорастворимого соединения и в чем она выражается?
3. Что называется термодинамическим и концентрационным произведением растворимости?
4. Какие факторы влияют на растворимость осадков?
5. Сформулируйте условия образования и растворения осадков.
|
|
|
6. Сформулируйте правило произведения растворимости.
7. Как связаны растворимость и произведение растворимости?
8. Как влияет присутствие одноименного иона на растворимость?
9. Как влияет на растворимость малорастворимых электролитов введение в их раствор, не содержащих одноименный ион сильных электролитов?
10. Как вычислить рН начала и конца осаждения гидроксидов?
11. Выведите формулу для расчета растворимости соединения А т В п.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 7078; Нарушение авторских прав?; Мы поможем в написании вашей работы!
