
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярная электрическая проводимость
|
|
|
|
Молярная электрическая проводимость (λ) — это электрическая
проводимость объема раствора электролита, содержащего 1 моль раство-
ренного вещества и находящегося между двумя параллельными электродами,
расположенными на расстоянии одного метра друг от друга.
Эквивалентная электрическая проводимость относится к раствору,
содержащему 1 моль-экв растворенного электролита. Однако в настоящее
время не рекомендуется использовать этот термин. Вместо него применяется
термин «молярная электрическая проводимость» с указанием той единицы
электролита, к которой относится концентрация.
Например,
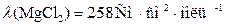 ,
,
но очевидно, что
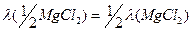 =129
=129 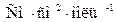 .
.
Для ионной электрической проводимости в случае
необходимости следует указывать формальную единицу: 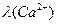 или
или 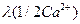 .
.
Молярная электрическая проводимость связана с удельной электрической
проводимостью простым соотношением:
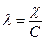 , (4.16)
, (4.16)
где 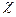 - удельная электрическая проводимость, [C]— молярная концентрация вещества.
- удельная электрическая проводимость, [C]— молярная концентрация вещества.
Следовательно, размерность 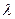 в единицах СИ:
в единицах СИ: 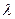 =См·моль-1·м2. В практических расчетах чаще используются производные единицы СИ:
=См·моль-1·м2. В практических расчетах чаще используются производные единицы СИ:
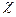 = См/см, (λ)= См ·моль-1 см2, [C]=моль· дм-3.
= См/см, (λ)= См ·моль-1 см2, [C]=моль· дм-3.
При этом вместо уравнения (4.16) получаем:
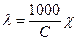 . (4.17)
. (4.17)
Зависимость λ от скорости движения для 1—1 валентных ионов выражается уравнением:
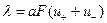 , (4.18)
, (4.18)
где 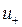 и
и 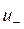 — абсолютные скорости движения положительных и отрицатель-
— абсолютные скорости движения положительных и отрицатель-
ных ионов, соответственно.
Для сильных электролитов α = 1, поэтому
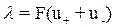 . (4.19)
. (4.19)
Произведения 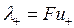 и
и 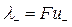 называются подвижностями ионов. Тогда:
называются подвижностями ионов. Тогда:
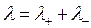 . (4.20)
. (4.20)
Для предельно разбавленных растворов 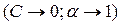
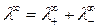 , (4.21)
, (4.21)
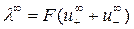 , (4.22)
, (4.22)
где 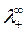 и
и 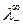 - подвижности ионов при предельном разведении.
- подвижности ионов при предельном разведении.
Уравнение (4.21) справедливо как для сильных, так и для слабых разбавленных электролитов и называется законом Кольрауша (законом аддитивности электропроводности), а также законом независимого движения ионов.
|
|
|
Численные значения подвижностей ионов 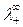 и
и 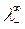 в настоящее время
в настоящее время
практически найдены для всех ионов и для Т= 298 К приводятся в справоч-
никах. Пользуясь этими данными, электропроводность предельно разбав-
ленного электролита (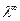 ) можно определить простым расчетом по
) можно определить простым расчетом по
уравнению (4.21).
Например, для уксусной кислоты:
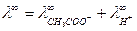 =35+315=350 См· моль-1· см2.
=35+315=350 См· моль-1· см2.
Сопоставление данных 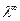 показывает, что аномально высокими
показывает, что аномально высокими
величинами электропроводностей в водном растворе обладают ионы
гидроксония и гидроксила. Это объясняется эстафетным механизмом
перемещения указанных ионов в растворе. Поэтому растворы кислот и
щелочей по сравнению с растворами солей при одинаковых концентрациях
обладают большей электрической проводимостью.
Из уравнений (4.19 и 4.22) получаем:
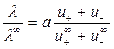 . (4.23)
. (4.23)
Откуда
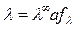 , (4.24)
, (4.24)
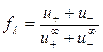 , (4.25)
, (4.25)
где 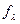 — коэффициент электропроводности, который характеризует степень элек-
— коэффициент электропроводности, который характеризует степень элек-
тростатического взаимодействия между ионами в растворе.
В разбавленных растворах слабых электролитов электростатическое
взаимодействие между ионами мало 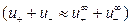 , поэтому
, поэтому 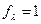 .
.
Для
таких растворов из (4.24) получаем
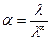 . (4.26)
. (4.26)
То есть степень диссоциации можно определить по значениям электропро-
водности, а так как 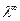 для электролита постоянна, то изменение электропро-
для электролита постоянна, то изменение электропро-
водности разбавленных растворов слабого электролита при изменении его
концентрации определяется только зависимостью от концентрации раствора.
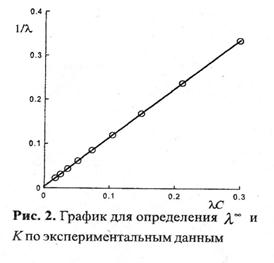
Экспериментальные данные зависимости электропроводности разбав-
ленного слабого 1—1 валентного электролита от его концентрации позволяют
графически определить величины 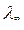 , К. Для этого уравнение (4.6) с использованием (4.26) приводят к линейному виду в координатах (1/ λ – λC):
, К. Для этого уравнение (4.6) с использованием (4.26) приводят к линейному виду в координатах (1/ λ – λC):
1/λ= 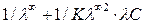 . (4.27)
. (4.27)
 Построив график в указанных
Построив график в указанных
координатах и продолжив прямую
линию графика до пересечения с осью
ординат, находят значение 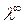 , как
, как
величину обратную величине отрезка
ординаты, отсекаемой линией графика.
К определяют из треугольника как отношение противолежащего катета к прилежащему катету в масштабах осей графика (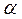 — острый угол наклона линии графика к оси абсцисс).
— острый угол наклона линии графика к оси абсцисс).
|
|
|
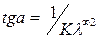 . (4.28)
. (4.28)
В тех случаях, когда, вследствие особенности распределения точек экспериментальных данных, экстраполяцию графика на ось ординат с необходимой точностью провести не удается, значение 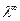 , для исследуемого раствора электролита берут из справочника.
, для исследуемого раствора электролита берут из справочника.
В концентрированных растворах слабых электролитов нужно учитывать коэффициент электрической проводимости (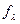 ) и коэффициенты активности ионов электролита.
) и коэффициенты активности ионов электролита.
Для сильных электролитов α = 1, тогда из (4.24):
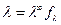 . (4.29)
. (4.29)
Таким образом, в растворах сильных электролитов изменение молярной
электрической проводимости с концентрацией раствора обусловлено
изменением коэффициента электрической проводимости (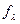 ), то есть,
), то есть,
влиянием электростатического взаимодействия ионов на скорость их движения.
Опыт показывает, что 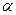 слабых электролитов изменяется с концентрацией
слабых электролитов изменяется с концентрацией
значительно сильнее, чем 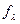 сильных электролитов. Поэтому кривая графика
сильных электролитов. Поэтому кривая графика
зависимости молярной электропроводности от концентрации раствора для
слабых электролитов падает значительно круче при увеличении концентрации,
чем кривая этой же зависимости для сильных электролитов (рис. 4.3).
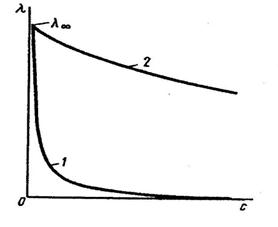 Наиболее известно эмпирическое уравнение Кольрауша для разбавленных растворов называемого законом квадратного корня:
Наиболее известно эмпирическое уравнение Кольрауша для разбавленных растворов называемого законом квадратного корня:
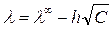 . (4.30)
. (4.30)
где h — эмпирический коэффициент.
 Эта зависимость подтверждена
Эта зависимость подтверждена
многочисленными экспериментами и
теоретически обоснована в теории Дебая -
Гюккеля - Онзагера, в которой
снижение молярной электропроводности
разбавленных растворов сильных
электролитов при увеличении
концентрации электролита объясняется
уменьшением скорости движения ионов
за счет электростатического взаимодей-
ствия ионов, окруженных их ионными
атмосферами при движении таких ионов
в электрическом поле.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 829; Нарушение авторских прав?; Мы поможем в написании вашей работы!