
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинаміка утворення і дисоціації карбонатів
|
|
|
|
Теоретичні основи утворення і дисоціації складних хімічних сполук
Найчастіше в металургійній промисловості застосовують вапняк (карбонат кальцію, СаСО3). Карбонатами називають солі вугільної кислоти, загальна формула карбонату: МеСО3, СаСО3 – вапняк; СаО – вапно, флюс. Також застосовуються карбонати магнію, заліза, марганцю. Доломіт (СаО, МgО)∙(СО3)2, використовується для виготовлення футеровки, наведення шлаку. Карбонати є рудами деяких металів. Як приклад можна привести сидерити – залізняк, що складається з FeCO3, або руди марганцю – родохрозит, що містять МnCO3.
Карбонати в загальному вигляді утворюються за екзотермічною реакцією:
МеО + СО2 = МеСО2 + Q,
константа рівноваги якої рівна 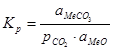 ; де
; де 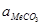 ,
, 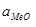 – активності карбонату і оксиду металу;
– активності карбонату і оксиду металу; 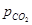 – рівноважний парціальний тиск діоксиду вуглецю. Якщо оксид металу і карбонат знаходяться у вигляді твердих або рідких речовин, тобто знаходяться в чистому вигляді, то активності їх рівні 1. Тоді константа рівноваги рівна 1/
– рівноважний парціальний тиск діоксиду вуглецю. Якщо оксид металу і карбонат знаходяться у вигляді твердих або рідких речовин, тобто знаходяться в чистому вигляді, то активності їх рівні 1. Тоді константа рівноваги рівна 1/ 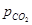 .
.
Це підтверджує і правило фаз Гіббса, по якому система матиме тільки один ступінь свободи, оскільки С = К – Ф + 2, К = 2; Ф = 3 і С = 1. Оскільки константа рівноваги залежить тільки від температури, то і величина 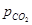 є функцією температури. Рівноважний парціальний тиск діоксиду вуглецю в реакції дисоціації вуглекислого з'єднання називається пружністю дисоціації карбонату. Для оцінки порівняльної міцності різних з'єднань або спорідненість оксидів до СО2 використовується величина термодинамічного ізобарного потенціалу або Δ G 0, яка рівна Δ G 0 = – RT ln(1/
є функцією температури. Рівноважний парціальний тиск діоксиду вуглецю в реакції дисоціації вуглекислого з'єднання називається пружністю дисоціації карбонату. Для оцінки порівняльної міцності різних з'єднань або спорідненість оксидів до СО2 використовується величина термодинамічного ізобарного потенціалу або Δ G 0, яка рівна Δ G 0 = – RT ln(1/ 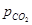 ) = RT ln
) = RT ln 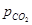 . Пружність дисоціації може служити мірою порівняльній міцності карбонату або спорідненості оксиду до СО2. Чим менше величина Δ G 0 і
. Пружність дисоціації може служити мірою порівняльній міцності карбонату або спорідненості оксиду до СО2. Чим менше величина Δ G 0 і 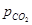 , тим більше міцність карбонату і навпаки. Оскільки реакції утворення карбонатів екзотермічні, то із зростанням температури константи рівноваги зменшуються, а
, тим більше міцність карбонату і навпаки. Оскільки реакції утворення карбонатів екзотермічні, то із зростанням температури константи рівноваги зменшуються, а 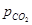 росте, тобто міцність карбонатів з нагрівом зменшується.
росте, тобто міцність карбонатів з нагрівом зменшується.
|
|
|
Для аналізу реакції дисоціації карбонату МеСО3 = МеО + СО2 і визначення можливого її напряму залежно від зовнішніх умов використовують перетворене рівняння ізотерми Вант-Гоффа 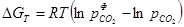 , де
, де 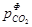 – фактичний парціальний тиск діоксиду вуглецю в атмосфері системи, а
– фактичний парціальний тиск діоксиду вуглецю в атмосфері системи, а 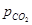 – пружність дисоціації. Напрям процесу залежатиме від співвідношення між цими величинами.
– пружність дисоціації. Напрям процесу залежатиме від співвідношення між цими величинами.
Якщо 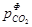 >
> 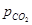 , тобто тиск СО2 в системі вищий рівноважного, то Δ G 0 > 0 і реакція може йти тільки у зворотний бік, у бік утворення карбонату.
, тобто тиск СО2 в системі вищий рівноважного, то Δ G 0 > 0 і реакція може йти тільки у зворотний бік, у бік утворення карбонату.
Якщо 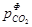 <
< 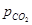 , тобто тиск СО2 в системі менше рівноважного, то Δ G 0 < 0 і реакція повинна йти у бік розкладання карбонату.
, тобто тиск СО2 в системі менше рівноважного, то Δ G 0 < 0 і реакція повинна йти у бік розкладання карбонату.
У випадку 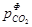 ==
== 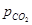 система знаходитиметься в стані рівноваги. Ці співвідношення показані на рис. 2.1.
система знаходитиметься в стані рівноваги. Ці співвідношення показані на рис. 2.1.
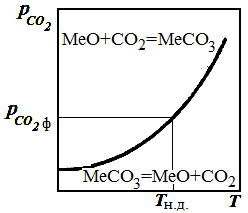
|
| Рис. 2.1 – Дисоціація карбонатів залежно від температури |
Крапки, що лежать на цій кривій, відповідають стану рівноваги реакції розкладання карбонату.
Область на діаграмі вище за криву рівноваги відповідає умовам, при яких 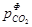 >>
>> 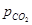 і можливе тільки утворення карбонату. В області нижче кривої
і можливе тільки утворення карбонату. В області нижче кривої 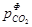 <<
<< 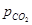 , і за цих умов відбувається розкладання карбонату.
, і за цих умов відбувається розкладання карбонату.
За допомогою даної діаграми можна визначити напрям процесу при будь-яких температурах і парціальному тиску СО2.
Для визначення напряму процесу при різних температурах і постійному тиску СО2 необхідно провести на діаграмі пряму, паралельну осі абсцис, відповідну даному значенню 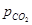 . Точка перетину прямої з рівноважною кривою визначить температуру початку розкладання карбонату при даному тиску СО2 в атмосфері (см. рис. 2.1). Ця температура називається температурою початку дисоціації карбонату. При всіх температурах вище даної відбувається розкладання карбонатів, а при нижчих при цьому тиску СО2 – утворення карбонату.
. Точка перетину прямої з рівноважною кривою визначить температуру початку розкладання карбонату при даному тиску СО2 в атмосфері (см. рис. 2.1). Ця температура називається температурою початку дисоціації карбонату. При всіх температурах вище даної відбувається розкладання карбонатів, а при нижчих при цьому тиску СО2 – утворення карбонату.
|
|
|
Для характеристики дисоціації карбонатів використовується поняття температури хімічного кипіння. При цій температурі пружність дисоціації карбонату стає рівною загальному тиску газу, при якому наступає інтенсивне розкладання карбонату. Для СаСО3 температура хімічного кипіння на повітрі при загальному тиску 101,3 кПа рівна 1183 К або 910 0С.
Міцність найважливіших карбонатів падає в наступній послідовності: СаСО3 > MgCО3 > FeCО3. Для металургійного виробництва має значення складний карбонат кальцію та магнію – доломит – (Са, Mg)·(CO3)2, дисоціація якого протікає за двома стадіями:
1 (Са, Mg)·(CO3)2 = СаСО3 + MgО + СО2
2 СаСО3 = СаО + СО2
Зв'язок пружності дисоціації з дисперсністю карбонатів
Пружність дисоціації карбонатів залежить від ступеня дисперсності частинок. Чим дрібніше за частинку, тим більше пружність дисоціації. Тому пружність дисоціації стає не тільки функцією температури, але і функцією характеру кристалічної структури, ступеня дисперсності.
Підвищення ступеня дисперсності супроводжується збільшенням активності карбонатної фази, яка вже не буде рівна 1 і тоді із співвідношення для константи рівноваги 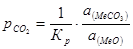 .
.
Тому із зростанням дисперсності 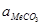 відбуватиметься зростання
відбуватиметься зростання 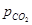 . Зменшення ж ступеня дисперсності оксиду і його активності приводитиме до зменшення пружності дисоціації карбонату. Дрібнодисперсний карбонат буде менш стійким, він легше розпадатиметься. В той же час дрібнодисперсний оксид, володіючи підвищеною хімічною активністю, повніше взаємодіятиме з СО2 і знижуватиме його рівноважний тиск в газовій фазі.
. Зменшення ж ступеня дисперсності оксиду і його активності приводитиме до зменшення пружності дисоціації карбонату. Дрібнодисперсний карбонат буде менш стійким, він легше розпадатиметься. В той же час дрібнодисперсний оксид, володіючи підвищеною хімічною активністю, повніше взаємодіятиме з СО2 і знижуватиме його рівноважний тиск в газовій фазі.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 744; Нарушение авторских прав?; Мы поможем в написании вашей работы!