
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы термохимии
Термохимия – раздел физической химии, который изучает тепловые эффекты реакций. Тепловые эффекты реакции – это наибольшее количества тепла, которое выделяется или поглощается при необратимо идущей химической реакции. При этом должно соблюдаться условие, чтобы система не совершала никакой работы, кроме расширения.
Если теплота поглощается системой, т.е. процесс является эндотермическим, величина Q берётся со знаком «плюс». В случае выделения тепла (экзотермический процесс), величина Q берётся со знаком «минус».
Согласно уравнениям (5) и (6), тепловой эффект реакций равен изменению функций состояния и приобретает свойства функций состояний состояния. В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведённой при постоянной температуре и постоянном давлении. На этом положении базируется основной постулат термохимии, сформулированный в 1840г. русским химиком акад. Гессом и называется законом Гесса:
Тепловой эффект химической реакции не зависит от пути протекания процесса, а определяется начальным и конечным состояниями системы.
Закон Гесса позволяет вычислять тепловой эффект реакции, если по каким-либо причинам его невозможно определить экспериментально.
Тепловой эффект реакции образования 1 моля данного вещества из простых в стандартных условиях (давлении 1 атм и температуре 25º С (298К)) называется стандартной теплотой образования Н 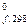 сложного вещества. Теплоты образования простых веществ равны нулю (O2, N2, H2 и др.). Теплоты образования Н
сложного вещества. Теплоты образования простых веществ равны нулю (O2, N2, H2 и др.). Теплоты образования Н 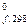 многочисленных соединений в стандартных условиях приводятся в термодинамических таблицах.
многочисленных соединений в стандартных условиях приводятся в термодинамических таблицах.
Из закона Гесса вытекают два следствия, позволяющие определять тепловые эффекты химических реакций, не прибегая к измерениям.
Первое следствие из закона Гесса: тепловой эффект химической реакции при стандартных условиях равен сумме стандартных теплот образования продуктов реакции, умноженных на стехиометрические коэффициенты, минус стандартные теплоты образования исходных веществ, умноженные на соответствующие коэффициенты:
 . (10)
. (10)
Теплотой сгорания ΔНсгор называют тепловой эффект реакции сгорания 1 моля данного вещества с образованием СО2, Н2О, N2 и др. Значения стандартных теплот сгорания ΔНсгор приводятся в справочных таблицах.
Второе следствие из закона Гесса: тепловой эффект химической реакции при стандартных условиях равен сумме стандартных теплот сгорания исходных веществ, умноженных на стехиометрические коэффициенты, минус стандартные теплоты сгорания продуктов реакции, умноженные на соответствующие коэффициенты:
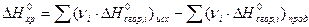 . (11)
. (11)
Индекс º у энтальпии образования и энтальпии сгорания указывает на стандартность условий, ν – число молей различных веществ.
Пример 1. Рассчитать тепловой эффект реакции получения водорода из природного газа в стандартных условиях
СН4 + 2 Н2О(г) = СО2 + 4Н2
|
|
Дата добавления: 2014-12-16; Просмотров: 752; Нарушение авторских прав?; Мы поможем в написании вашей работы!