
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. Второй закон термодинамики устанавливает критерии, позволяющие определить направление самопроизвольного протекания процессов
|
|
|
|
Второй закон термодинамики устанавливает критерии, позволяющие определить направление самопроизвольного протекания процессов.
Самопроизвольными называют процессы, которые протекают в системе без затраты энергии извне.
Процессы бывают обратимыми и необратимыми. Необратимые процессы идут самопроизвольно лишь в одном направлении. После протекания данных процессов, сопровождающихся изменениями в системе и окружающей среде, невозможно вернуть одновременно и систему и окружающую среду в исходное состояние.
Обратимыми являются процессы, после которых систему и окружающую среду можно вернуть в исходное состояние.
Второй закон термодинамики имеет несколько формулировок, в варианте, предложенном Клаузиусом, он выглядит следующим образом: невозможен самопроизвольный переход теплоты от холодного тела к горячему.
Физический смысл второго закона термодинамики заключается в том, что любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного состояния переходит в более вероятное состояние. Другими словами, самопроизвольному протеканию процесса способствует увеличение неупорядоченности в системе.
Для характеристики меры неупорядоченности используется термодинамическая функция – энтропия S, которая связана с термодинамической вероятностью системы формулой Больцмана:
S = k · lnW, (25)
где k – постоянная Больцмана.
Под термодинамической вероятностью W понимают число равновероятных микроскопических состояний, которыми может быть реализовано данное макроскопическое состояние системы. Для определения термодинамической вероятности системы необходимо найти число различных вариантов положений всех частиц системы в пространстве.
|
|
|
Энтропия является количественной мерой беспорядка в системе. Чем больше W, тем хаотичнее система, тем больше величина энтропии. Нагревание вещества приводит к увеличению энтропии, а охлаждение – к уменьшению. При приближении к абсолютному нулю (-273ºС) энтропия стремится к нулю, что позволяет определить абсолютные значения энтропии различных веществ, значения которых при стандартных условиях представлены в таблицах. Следует отметить, что в отличие от энтальпии образования, энтропия простого вещества, даже находящегося в кристаллическом состоянии, не равна нулю, т.к. при температуре, отличающейся от абсолютного нуля, макросостояние кристалла может быть реализовано не единственным макросостоянием, а большим числом равновероятных состояний.
Другая формулировка второго закона термодинамики выглядит так: полная энтропия всегда увеличивается в самопроизвольном процессе.
Увеличение энтропии ΔS при протекании процесса должно превышать или быть равным отношению количества теплоты Q, переданного системе, к температуре Т, при которой теплота передаётся:
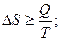
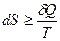 . (26)
. (26)
Уравнение (26) является математической записью второго начала термодинамики. В данном уравнении знак неравенства относится к необратимым самопроизвольным процессам, а знак равенства – к обратимым процессам.
Согласно уравнению (26), изменение энтропии при обратимом переходе системы из состояния 1 в состояние 2 можно определить как:
ΔS = S2 – S1 =  . (27)
. (27)
Фазовые переходы сопровождаются тепловым эффектом, называемым теплотой фазового перехода ΔНф.п., и являются изотермическими процессами (Тф.п.= const). Для фазового перехода одного моля вещества изменение энтропии равно:
ΔSф.п.=  . (28)
. (28)
В процессах плавления, испарения жидкости или сублимации вещества энтропия увеличивается, так как разрушается упорядоченная кристаллическая решётка. Обратные процессы: кристаллизации, конденсации, десублимации сопровождаются уменьшением неупорядоченности в системе, и следовательно, уменьшением энтропии.
|
|
|
При изменении температуры вещества от Т1 до Т2 при постоянном давлении изменение энтропии определяется по формуле:
ΔS = 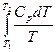 , (29)
, (29)
поскольку Ср = const, то
ΔS = Ср· ln  . (30)
. (30)
Для изохорных процессов
ΔS = 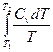 , (31)
, (31)
при Сv = const
ΔS = Сv· ln  . (32)
. (32)
Стандартной энтропией ΔS 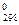 называется энтропия 1 моля вещества в стандартных условиях. Изменение стандартной энтропии ΔS
называется энтропия 1 моля вещества в стандартных условиях. Изменение стандартной энтропии ΔS 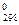 при протекании химической реакции можно рассчитать по уравнению, основываясь на следствии из закона Гесса:
при протекании химической реакции можно рассчитать по уравнению, основываясь на следствии из закона Гесса:
ΔS 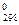 =
= 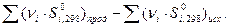 (33)
(33)
Наиболее хаотичной формой вещества является газообразное состояние, поэтому если в результате химической реакции число молей газа увеличивается, то хаотичность, а следовательно, и энтропия системы возрастает.
Обычно определяют не абсолютн6ое значение энтропии, а её изменение (S2 – S1) в том или ином процессе. Для вычисления изменения энтропии при переходе одного моля идеального газа из одного состояния в другое используют формулы:
S2 – S1 = R 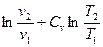 (34)
(34)
S2 – S1 = R  (35),
(35),
где Ср и Сv – постоянные величины. Изменение энтропии при нагревании единицы массы вещества, находящегося в твёрдом или жидком состоянии, рассчитывают по формуле:
S2 – S1 = 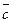 ln
ln  (36),
(36),
где 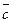 - удельная теплоёмкость вещества.
- удельная теплоёмкость вещества.
При переходе вещества из одного агрегатного состояния в другое изменение энтропии определяется по формуле:
S2 – S1 = 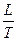 (37),
(37),
где L – скрытая теплота обратимого фазового перехода (испарения, плавления и др.); Т – температура фазового перехода.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 774; Нарушение авторских прав?; Мы поможем в написании вашей работы!